அமிலங்கள், காரங்கள் மற்றும் உப்புகள்
இராஜதிராவகம்:
உலோகங்களில் தங்கம் மற்றும் வெள் ளி மட்டுமே HCl மற்றும் HNO3 உடன் வினைபுரியாது என்பது நாம் அறிந்த ஒன்று. ஆனால் இந்த இரண்டு அமிலங்களின் கலவை தங்கத்தைக் கரைக்கும் திறனுள்ளது. அந்த கலவையின் பெயர் இராஜதிராவகம் எனப்படும். இராஜதிராவகம் என்பது மூன்று பங்கு ஹைட்ரோகுளோரிக் அமிலம், ஒரு பங்கு நைட்ரிக் அமிலம் கலந்த கலவை ஆகும். இதன் மோலார் விகிதம் 3:1. இது மஞ்சள் – ஆரஞ்சு நிறமுடைய புகையக்கூடிய திரவம் ஆகும். இது தங்கம் மற்றும் சில கடின உலோகங்களையும் அதிக அளவில் அரிமானம்செய்யக்கூடிய திறன்கொண்டது.
இராஜ திராவகம் என்ற சொல் இலத்தீன் மொழியிலிருந்து பெறப்பட்டது. இதன் பொருள் திரவத்தின் அரசன் என்பதாகும். இது மிகுந்த ஆற்றல் கொண்டது. இராஜதிராவகம் மிக உன்னதமா ன நிலையில் உள்ள தங்கம், பிளாட் டினம் மற்றும் பெல்லேடியம் போன்ற உலோ கங்களைக் கூட கரைக்கவல்லது.
வேதி வாய்பாடு: 3 HCl + HNO3
நீரில் கரைதிறன்: கரையும்
உருகு நிலை: – 42°C (- 44°F, 231K)
கொதி நிலை: 108°C (226°F, 381K)
இராஜதிராவகத்தின் பயன்கள்:
- தங்கம் மற்றும் பிளாட்டினம் போன்ற உலோகங்களைக் கரைப்பதற்கு முதன்மையாகப் பயன்படுத்தப்படுகிறது.
- தங்கத்தை சுத்தம் செய்யவும், சுத்திகரிக்கவும் பயன்படுகிறது.
நடுநிலையாக்கல் வினை:
வேறுபட்ட வேதிப்பண்புகளைக் கொண்டுள்ள இரண்டு வேதிப்பொருள்கள் ஒரு வேதிவினையின் மூலம் நடுநிலை அடையும் நிகழ்வு நடுநிலையாக்கல் எனப்படும். எனவே, நடுநிலையாக்கல் என்பது அமிலமும் காரமும் வினைபுரிந்து உப்பையும் நீரையும் உருவாக்கும் வினை ஆகும். நடுநிலையாக்கல் வினையை கீழ்க்காணுமாறு குறிப்பிடலாம்.
அமிலம் + காரம் → உப்பு + நீர்
இந்த வினையில் ஹைட்ரோ குளோரிக் அமிலமானது H+ மற்றும் Cl– அயனிகளையும், சோடியம் ஹைட்ராக்சைடானது Na+ மற்றும் OH– அயனிகளையும் தருகின்றது. இந்த அயனிகள் இணைந்து சோடியம் குளோரைடு மற்றும் நீர் ஆகியவை உருவாகின்றன.
அமிலம் | காரம் | உப்பு |
ஹைட்ரோ குளோரிக் அமிலம் HCl | சோடியம் ஹைட்ராக்சைடு NaOH | சோடியம் குளோரைடு NaCl |
சல்பியூரிக் அமிலம் H2 SO4 | சோடியம் ஹைட்ராக்சைடு NaOH | சோடியம் சல்பேட் Na2 SO4 |
நைட்ரிக் அமிலம் HNO3 | சோடியம் ஹைட்ராக்சைடு NaOH | சோடியம் நைட்ரேட் NaNO3 |
அசிட்டிக் அமிலம் CH3 COOH | சோடியம் ஹைட்ராக்சைடு NaOH | சோடியம் அசிட்டேட் CH3 COONa |
இதைப்போலவே, பிற அமிலங்களும் காரங்களுடன் வினைபுரிந்து உப்புகளைத் தருகின்றன.
நம் அன்றாட வாழ்வில் நடைபெறும் நடுநிலையாக்கல் வினைகள்:
அமிலங்களையும், காரங்களையும் சமநிலைப் படுத்துவது நமது ஆரோக்கியத்திற்கும் சுற்றுச்சூழலுக்கும் அவசியமாகும். நமது அன்றாட வாழ்வில் பல்வேறு நடுநிலையாக்கல் வினைகளைப் பார்க்கின்றோம். அவற்றுள் சில வினைகளின் முக்கியத்துவத்தைப் பற்றி இங்கு கற்போம்.
தேனீ கொட்டுதல்
நம்மை சிவப்பு எறும்பு கடிக்கும்பொழுது அல்லது தேனீ கொட்டும்பொழுது ஃபார்மிக் அமிலமானது தோலினுள் உட்செலுத்தப்படுகிறது. இந்த அமிலமானது எரிச்சல் உணர்வினையும் வலியினையும் உண்டாக்குகிறது. வலி மற்றும் எரிச்சல் உணர்வுள்ள இடத்தில் கால்சியம் ஹைட்ராக்சைடை (வீடுகளில் பயன்படுத்தப்படும் நீற்றுச் சுண்ணாம்பு) தேய்த்து ஃபார்மிக் அமிலம் நடுநிலையாக்கப்படுகிறது.
குளவி கொட்டுதல்
குளவி கொட்டும்பொழுது, எரிச்சல் போன்ற உணர்வினையும், வலியினையும் நாம் உணர்கிறோம். இது குளவியால் நமது உடலில் செலுத்தப்படும் அல்கலி என்ற காரப்பொருளின் மூலம் ஏற்படுகிறது. இந்த காரத்தன்மையை நடுநிலையாக்க நாம் அமிலத்தன்மை கொண்ட வினிகரைப் பயன்படுத்துகிறோம்.
பற்சிதைவு
பொதுவாக ஒரு நாளைக்கு இரண்டு முறை நாம் பல் துலக்க வேண்டும் என மருத்துவர்கள் அறிவுறுத்துகின்றனர். ஏனெனில், நம் வாயில் இருக்கும் பாக்டீரியாக்கள் பற்களுக்கு இடைப்பட்ட இடைவெ ளிகளில் சிக்கியுள்ள உணவுத் துகள்களைச் சிதைத் து அதன் மூலம் அமிலத்தை உருவாக்குகின்றன. இது பற்சிதைவுக்கு வழி வகுக்கிறது. இதனைத் தடுக்க நாம் அமிலத்தை நடுநிலையாக்க வேண்டும். வலிமை குறைந்த காரங்களைக் கொண்ட பற்பொடி அல்லது பற்பசையைக் கொண்டு பல் துலக்கும்போது அமிலமானது நடுநிலையாக்கப்படுகிறது. இதனால், பற்கள் வலுவாகவும், ஆரோக்கியமாகவும் இருக்கும்.
அமிலத்தன்மை
நமது உடலில் கல்லீரல், பித்தப்பை மற்றும் கணையம் ஆகியவற்றால் சுரக்கப்படும் நொதிகளும் வயிற்றில் சுரக்கும் ஹைட்ரோகுளோரிக் அமிலமும் சேர்ந்து உணவுப் பொருள்களின் செரிமானத்திற்கு உதவுகின்றன. சில நேரங்களில் நம் வயிற்றில் சுரக்கும் ஹைட்ரோகுளோரிக் அமிலம் அதிகப்படியாக சுரப்பதால் உணவுக்குழாய் மற்றும் மார்புப் பகுதிகளில் எரிச்சல் உணர்வினை நாம் உணர்கிறோம். இது மீண்டும் மீண்டும் ஏற்பட்டால் வயிறு மற்றும் உணவுக்குழாய்களில் புண் உருவாகி, பாதிப்பு மேலும் அதிகரிக்கிறது. இதனை நடுநிலையாக்க வலிமை குறைந்த காரங்களான மெக்னீசியம் ஹைட்ராக்சைடு மற்றும் அலுமினியம் ஹைட்ராக்சைடு போன்றவற்றின் கலவை அமில நீக்கியாகப் பயன்படுகிறது. இதன் விளைவாக அமிலத்தன்மை நீக்கப்படுகிறது.
வேளாண்மை
அதிக அமிலத்தன்மையுடைய மண் தாவர வளர்ச்சிக்கு ஏற்றதல்ல. எனவே, இதனைச் சரிசெய்வதற்கு விவசாயிகள் சுண்ணாம்பு (Cao), சுண்ணாம்புக் கற்கள் (Caco3) அல்லது மரக்கட்டைகளை எரிப்பதால் கிடைக்கும் சாம்பல் ஆகியவற்றை மண்ணில் சேர்க்கின்றனர். இது மண்ணின் காரத் தன்மையை நடுநிலையாக்குகிறது.
தொழில்துறை
தொழிற்சாலைகளிலிருந்து வெளியேற்றப்படும் கழிவுகளில் சல்பியூரிக் அமிலம் உள்ளது. ஆறுகள் மற்றும் நீரோடைகளின் வழியாக கழிவுகளை வெளியேற்றும் முன் அவற்றுடன் சுண்ணாம்பு சேர்க்கப்படுகிறது. இதேபோல், மின் உற்பத்தி நிலையங்களில் மின்சாரம் தயாரிப்பதற்கு நிலக்கரி போன்ற புதைபடிவ எரிபொருள்கள் எரிக்கப்படுகின்றன. அவை எரியும்போது சல்பர் டைஆக்சைடு உருவாகிறது. எனவே, இந்த அமிலத்தன்மை மிக்க வாயு மின் நிலையங்களில் சுண்ணாம்புத்தூள் அல்லது சுண்ணாம்புக் கற்களைக் கொண்டு நடுநிலையாக்கப்படுகிறது. இவ்வாறு, சல்பர் டைஆக்சைடால் ஏற்படும் காற்று மாசுபாடு தடுக்கப்படுகிறது.
நிறங்காட்டி
நிறங்காட்டி அல்லது அமில – கார நிறங்காட்டி என்பது ஒரு வேதிப் பொருளாகும். ஒரு வேதிப்பொருள் அமிலத்தன்மை உடையதா அல்லது காரத்தன்மை உடையதா என்பதை பொருத்தமான நிறமாற்றத்தின் அடிப்படையில் இது குறிக்கிறது. இது இயற்கையானதாகவோ அல்லது செயற்கையானதாகவோ இருக்கலாம்.
இயற்கை நிறங்காட்டி
இயற்கை நிறங்காட்டி என்பது இயற்கை மூலத்திலிருந்து பெறப்படும் வேதிப்பொ ருள் ஆகும். லிட்மஸ், மஞ்சள் சாறு, செம்பருத்திப் பூ மற்றும் பீட்ரூட் சாறு ஆகியவை இயற்கை மூலங்களிலிருந்து பெறப்படும் இயற்கை நிறங்காட்டிகளாகும்.
மஞ்சள் நிறங்காட்டி
மஞ்சள் தூளில் சிறிதளவு நீரைச் சேர்த்து மஞ்சள் தூள் பசை தயாரிக்கப்படுகிறது. இது மை உறிஞ்சும் தாள் அல்லது வடிதாளின் மீது பூசப்பட்டு உலர்த்தப்படுகிறது. ஒரு கரைசலின் அமில மற்றும் காரத் தன்மையைக் கண்டறிய மஞ்சள் தூள் நிறங்காட்டி பயன்படுகிறது. அமிலக் கரைசலில் மஞ்சள் நிறங்காட்டி எந்த ஒரு குறிப்பிடத்தக்க நிற மாற்றத்தையும் தராது. அது மஞ்சளாகவே இருக்கும். ஆனால், காரக் கரைசலில் அது மஞ்சள் நிறத்திலிருந்து சிவப்பு நிறமாக மாறுகிறது.
செம்பருத்திப்பூ நிறங்காட்டி
வெந்நீரில் சில செம்பருத்திப் பூ இதழ்களைப் போட்டு 5 முதல் 10 நிமிடம் வரை ஊறவைக்கவும். இது ஒரு கரைசலை உருவாக்கும். இக்கரைசலை வடிகட்டி, நிறங்காட்டியாகப் பயன்படுத்தலாம். இந்த நிறங்காட்டியை அமிலக்கரைசலில் சேர்க்கும் போது இளஞ்சிவப்பு (பிங்க்) நிறத்தையும், காரக்கரைசலில் சேர்க்கும் போது பச்சை நிறத்தையும் அது தருகிறது.
பீட்ரூட் சாறு நிறங்காட்டி
நாம் உண்ணும் பீட்ரூட்டிலிருந்து சாற்றை எடுத்து நிறங்காட்டியாகப் பயன்படுத்தலாம். ஒரு கரைசலானது அமிலமா அல்லது காரமா என்பதை அடையாளம் காண இது பயன்படுகிறது.
லிட்மஸ் நிறங்காட்டி
லிட்மஸ் தாள் பொதுவாக ஆய்வகங்களில் பயன்படுத்தப்படும் ஒரு அமில – கார நிறங்காட்டி ஆகும். லிட்மஸ் என்பது ஒரு இயற்கையான நிறங்காட்டி. இது லைக்கன்களிலிருந்து பிரித்தெடுக்கப்படுகிறது. இது கரைசல் வடிவிலோ அல்லது லிட்மஸ் கரைசலை உறிஞ்சிவதன் மூலம் தயாரிக்கப்பட்ட வடிதாள் வடிவிலோ கிடைக்கின்றது. இந்தத் தாள் சிவப்பு அல்லது நீல நிறத்தில் இருக்கும். நீல லிட்மஸ் தாள் அமிலக் கரைசலில் சிவப்பு நிறமாகவும், சிவப்பு லிட்மஸ் தாள் காரக் கரைசலில் நீல நிறமாகவும் மாறும்.
செயற்கை நிறங்காட்டி
செயற்கையான பொருள்களிலிருது தயாரிக்கப்பட்ட நிறங்காட்டி செயற்கை நிறங்காட்டி என அழைக்கப்படுகிறது. பினாப்தலீன் மற்றும் மெத்தில் ஆரஞ்சு ஆகியவை செயற்கை நிறங்காட்டிகளுக்கு சில எடுத்துக்காட்டுகளாகும்.
பினாப்தலீன்
பினாப்தலீன் ஒரு நிறமற்ற சேர்மம். பினாப்தலீனுடன் ஆல்கஹால் கலந்த கரைசல் நிறங்காட்டியாகப் பயன்படுகிறது. இது அமிலக்கரைசலில் நிறமற்றதாகவும், காரக் கரைசலில் இளஞ்சிவப்பு நிறமாகவும் மாறும்.
மெத்தில் ஆரஞ்சு
சூடான நீரில் திட நிலையிலுள்ள மெத்தில் ஆரஞ்சு கரைக்கப்பட்டு வடிகட்டி நிறங்காட்டியாகப் பயன்படுத்தப்படுகிறது. இது அமிலக்கரைசலில் சிவப்பு நிறமாகவும், காரக் கரைசலில் மஞ்சளாகவும் நிறமாற்றம் அடைகிறது.
அமில மற்றும் கார ஊடகத்தில் வெவ்வேறு வகையான நிறங்கா ட்டிகள் அடையும் நிறமாற்றம் கீழ்க்காணும் அட்டவணையில் கொடுக்கப்பட்டுள்ளது.
நிறங்காட்டி | அமிலக் கரைசல் | காரக் கரைசல் |
நீல லிட்மஸ் தாள் | சிவப்பு | நிறமாற்றம் இல்லை |
சிவப்பு லிட்மஸ் தாள் | நிறமாற்றம் இல்லை | நீலம் |
பினாப்தலீன் | நிறமற்றது | இளஞ்சிவப்பு |
மெத்தில் ஆரஞ்சு | சிவப்பு | மஞ்சள் |
நீரின் அயனிப் பெருக்கம்
தூய நீர் ஒரு மின்கடத்தாப் பொருள் என்று பெரும்பாலும் கருதப்பட்டாலும் துல்லியமான அளவீடுகள் தூய நீர் சிறிதளவு மின்சாரத்தைக் கடத்துகிறது என்பதைக் காட்டுவது. கண்டறியப்பட்டுள்ளது. இது நீரின் தன் அயனியாதல் விளைவால் நடைபெறுகிறது. நீரின் சுய அல்லது சுய அயனியாதல் என்பது இரு நீர் மூலக்கூறுகள் இணைந்து அயனிகளைச் தோற்றுவிக்கும் நிகழ்வதாகும். இந்நிகழ்வின்போது ஒரு நீர் மூலக்கூறிலிருந்து ஒரு புரோட்டான் மற்றொரு நீர் மூலக்கூறுக்கு மாற்றப்பட்டு, ஹைட்ராக்ஸைடு அயனிகள் உருவாகின்றன. புரோட்டான் மற்றொரு நீர் மூலக்கூறுடன் சேர்ந்து ஹைட்ரோனியம் அயனியாக கீழ்க்கண்டவாறு உருவாகிறது.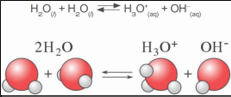
இவ்வாறு உருவாகும் ஹைட்ரோனியம் அயனி ஒரு வலிமையான அமிலம் ஆகும். ஹைட்ராக்சில் அயனி ஒரு வலிமையான காரம் ஆகும். எனவே அவை உருவானவுடன் மீண்டும் இணைந்து நீரைத் தருகின்றன. இது ஒரு மீள் வினையாகும். மேலும் இவ்வினை விரைவில் சமநிலையை அடைகிறது. எனவே உருவான அயனிகளின் செறிவு மிகக் குறைவாகும். இந்த ஹைட்ராக்சில் மற்றும் ஹைட்ரோனியம் அயனியின் செறிவுகளின் பெருக்குத் தொகையே நீரின் அயனிப்பெ ருக்கம் எனப்ப டுகிறது. இது Kw என்றழைக்கப்படுகிறது. இது கணிதச் சமன்பாடாக கீழ்க்கண்டவாறு குறிக்கப்படுகிறது.![]()
[H3O+] ஐ எளிமையாக [H+] என எழுதலாம். எனவே நீரின் அயனிப்பெ ருக்கத்தை Kw = [H+] [OH–] என எழுதலாம்.
இதன் அலகு மோல்2 டெசிமீ-6 25 °C இதன் மதிப்பு 1.00 x 10-14.
அன்றாட வாழ்வில் pH இன் பங்கு
நமது உடலானது 7.0 முதல் 7.8 வரை உள்ள pH எல்லை சார்ந்து வேலை செய்கிறது. உயிரினங்கள் ஒரு குறுகிய pH எல்லைக்குள் மட்டுமே உயிர் வாழ இயலும். நம் உடலில் உள்ள திரவங்கள் வெவ்வேறு pH மதிப்புகளைக் கொண்டவை. எடுத்துக்காட்டாக மனித ரத்தத்தின் pH மதிப்பு 7.35 லிருந்து 7.45 ஆகும். இந்த மதிப்பிலிருந்து குறைந்தாலோ அல்லது அதிகரித்தாலோ, அது நோயை உண்டாக்கும்.
மனித செரிமான மண்டலத்தில் pH மதிப்பு
நமது இரைப்பை ஹைட்ரோகுளோரிக் அமிலத்தை சுரக்கிறது என்பது ஒரு வியப்பூட்டும் செய்தியாகும். இந்த அமிலம் இரைப்பையை பாதிக்காமல் உணவைச்செரிக்க உதவுகிறது. சரியான செரிமானம் இல்லாதபோது இரைப்பையானது கூடுதலான அமிலத்தைச் சுரந்து வலியையும், எரிச்சலையும் ஏற்படுத்துகிறது. இரைப்பையில் உள்ள திரவத்தின் தோராயமான pH மதிப்பு 2.0 ஆகும்.
pH மாற்றம் – பற்சிதைவுக்குக் காரணம்
மனித உமிழ்நீரின் pH மதிப்பு 6.5 – 7.5 வரை உள்ளது. நமது பற்களின் மேற்பரப்பு படலமானது கால்சியம் பாஸ்பேட் என்ற மிகக் கடினமான பொருளினால் ஆனது. ஏனெனில் உமிழ்நீரின் pH 5.5 க்கும் கீழே குறையும்பொ ழுது பற்களின் மேற்பரப்பு படலம் (எனாமல்) பாதிக்கப்ப டுகிறது. இது பற்சிதைவு எனப்ப டுகிறது. பொதுவாக நாம் பயன்படுத்தப்ப டும் பற்பசைகள் காரத்தன்மை கொண்டவை. இவை கூடுதல் அமிலத்தன்மையை நடுநிலையாக்கம் செய்து பற்சிதைவைத் தடுக்கின்றன.
மண்ணின் pH
விவசாயத்திற்கு மண்ணின் pH மிக முக்கியத்துவம் வாய்ந்தது. சிட்ரிக் அமிலம் கொண்ட பழங்கள் சற்று காரத்தன்மை உள்ள மண்ணிலும், நெல் அமிலத்தன்மை கொண்ட மண்ணிலும், கரும்பு நடுநிலைத்தன்மை கொண்ட மண்ணிலும் வளரும்.
மழை நீரின் pH
மழை நீரின் pH மதிப்பு ஏறக்குறைய 7 ஆகும். இது, மழைநீர் நடுநிலைத்தன்மையானது மற்றும் தூய்மையானது என்பதைக் குறிக்கிறது. வளிமண்டலக் காற்று சல்பர் டை ஆக்சைடு, நைட்ரஜன் ஆக்சைடுகள் ஆகிய வாயுக்களால் மாசுபடும் பொழுது அவை மழைநீரில் கரைந்து pH மதிப்பை 7ஐ விடக் குறையச் செய்கின்றன. இவ்வாறு மழைநீரின் pH 7ஐ விட குறையும் பொழுது அம்மழை அமிலமழை எனப்படுகிறது. இந்த அமிலமழை நீர் ஆறுகளில் சேரும் பொழுது அவற்றின் pH ஐ குறைக்கின்றன. இதனால் நீர்வாழ் உயிரிகளின் வாழ்வு பாதிக்கப்படுகிறது.
அமிலங்கள் மற்றும் காரங்களின் கோட்பாடு:
அரீனியஸ் கொள்கை:
அமிலங்கள் மற்றும் காரங்கள் பற்றிய பழமையான கொள்கைகளில் ஒன்று ஸ்வீடன் நாட்டு வேதியியலாளர் ஸ்வாண்டே அரீன்யஸ் என்பவரால் முன்மொழியப்பட்டது. அவரின் கூற்றுப்படி, அமிலம் என்பது, நீர்க்கரைசலில் பிரிகையடைந்து ஹைட்ரஜன் அயனிகளை தரவல்ல ஒரு சேர்மமாகும். எடுத்துக்காட்டாக, HCl, H2SO4 போன்றவை அமிலங்களாகும். நீர்க்கரைசலில் அவற்றின் பிரிகையாதல் பின்வருமாறு குறிப்பிடப்படுகிறது.![]()
நீர்க்கரைசலிலுள்ள H+ அயனியானது அதிகளவில் நீரேற்றமடைந்து காணப்படுகிறது, பொதுவாக H3O+ என குறிப்பிடப்படுகின்றன. [H(H2O)]+ என்பது புரோட்டானின் மிக எளிய நீரேறிய அமைப்பாகும். இதை குறிப்பிட H+ மற்றும் H3O+ ஆகிய இரண்டையும் பயன்படுத்துவோம்.
இதேபோல, காரம் என்பது, நீர்க்கரைசலில் பிரிகையடைந்து ஹைட்ராக்ஸில் அயனிகளை தரவல்ல ஒரு சேர்மமாகும். எடுத்துக்காட்டாக, NaOH, Ca(OH)2 போன்ற சேர்மங்கள் காரங்களாகும்.![]()
அரீனியஸ் கொள்கையின் வரம்புகள்:
- அசிட்டோன், டெட்ராஹைட்ரோஃப்யுரான் போன்ற கரிம கரைப்பான்களில் அமில மற்றும் காரங்களின் பண்பினை அரீனியஸ் கொள்கை விளக்கவில்லை
- ஹைட்ராக்ஸில் தொகுதியை கொண்டிராத அம்மோனியா (NH3) போன்ற சேர்மங்களின் காரத்தன்மையினை இக்கொள்கை விளக்கவில்லை.
லெளரி – ப்ரான்ஸ்டட் கொள்கை (புரோட்டான் கொள்கை)
1923 ஆம் ஆண்டு, லெளரி மற்றும் ப்ரான்ஸ்டட் ஆகியோர் அமிலங்கள் மற்றும் காரங்கள் பற்றிய மிகப் பொதுவான ஒரு கொள்கையை முன்மொழிந்தனர். அவர்களின் கொள்கைப்படி, அமிலம் என்பது மற்றொரு பொருளுக்கு ஒரு புரோட்டானை வழங்கக்கூடிய ஒரு பொருளாகும். காரம் என்பது மற்றொரு பொருளிலிருந்து ஒரு புரோட்டானை ஏற்கக்கூடிய ஒரு பொருளாகும். அதாவது, அமிலம் என்பது ஒரு புரோட்டான் வழங்கி, மற்றும் காரம் என்பது ஒரு புரோட்டான் ஏற்பி.
ஹைட்ரஜன் குளோரைடை நீரில் கரைக்கும்போது, அது, நீர் மூலக்கூறுக்கு ஒருபுரோட்டானை வழங்குகிறது. அதாவது, HCl ஒரு அமிலமாகவும், H2O ஒரு காரமாகவும் நடந்துகொள்கின்றன. அமிலத்திலிருந்து காரத்திற்கு புரோட்டான் மாற்றப்படும் நிகழ்வை பின்வருமாறு குறிப்பிடலாம்.![]()
அம்மோனியாவைநீரில்கரைக்கும்போது, அதுநீரிலிருந்துஒருபுரோட்டானைஏற்றுக்கொள்கிறது. இந்த நேர்வில், அம்மோனியா (NH3) மூலக்கூறு ஒரு காரமாகவும், H2O மூலக்கூறு அமிலமாகவும் செயல்படுகின்றன. வினையானது பின்வருமாறு குறிப்பிடப்படுகிறது.![]()
இதன் மறுதலை வினையை பின்வரும் சமநிலையில் கருதுவோம்.![]()
H3O+ ஆனது Cl– க்கு ஒரு புரோட்டானை வழங்கி HCl ஐ உருவாக்குகிறது. அதாவது, விளைபொருட்களும் அமிலம் மற்றும் காரங்களாக செயல்படுகின்றன. பொதுவாக, லெளரி – ப்ரான்ஸ்டட் (அமிலம் – கார) வினையை பின்வருமாறு எழுதப்படுகிறது.![]()
ஒரு புரோட்டானை வழங்கிய பிறகு எஞ்சியுள்ள பகுதி ஒரு காரமாகும் (காரம்1) மேலும் இது ப்ரான்ஸ்டட்அமிலத்தின்(அமிலம்1) இணைகாரம்என்றழைக்கப்படுகிறது. அதாவது ஒரு புரோட்டானால் மட்டும் வேறுபடும் வேதிக்கூறுகள் இணைஅமில-கார இரட்டைகள் என்றழைக்கப்படுகின்றன.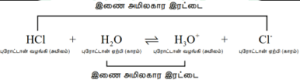
HCl மற்றும் Cl–, H2O மற்றும் H3O+ ஆகியன இரண்டும், வெவ்வேறு இணைஅமில – கார இரட்டைகளாகும். அதாவது, Cl– என்பது HCl அமிலத்தின் இணை காரம் (அல்லது) HCl என்பது Cl– அயனியின் இணைஅமிலம் ஆகும். இதேபோல H3O+ என்பது H2O வின் இணைஅமிலமாகும்.
லெளரி – ப்ரான்ஸ்டட் கொள்கையின் வரம்புகள்:
- BF3, AlCl3 போன்ற புரோட்டான்களை வழங்க இயலாத சேர்மங்களும் அமிலங்கள் போல செயல்படுவதை இக்கொள்கை விளக்கவில்லை.
லூயி கொள்கை:
1923 ஆம் ஆண்டு, கில்பர்ட். N. லூயி என்பவர், அமில மற்றும் காரங்கள் பற்றிய மிகப் பொதுவான ஒரு கொள்கையை முன்மொழிந்தார். இவர் எலக்ட்ரான் இரட்டைகளை கருத்திற்கொண்டு ஒரு சேர்மத்தை அமிலம் அல்லது காரம் என வரையறுத்தார். இவரின் கருத்துப்படி, எலக்ட்ரான் இரட்டையை ஏற்றுக்கொள்ளும் சேர்மம் அமிலம் ஆகும். காரம் என்பது எலக்ட்ரான் இரட்டையை வழங்கும் சேர்மமாகும். இத்தகைய சேர்மங்களை நாம் லூயி அமிலங்கள் மற்றும் லூயி காரங்கள் என அழைக்கிறோம்.
லூயி அமிலம் என்பது ஒரு நேர்மின் அயனி (அல்லது) ஒரு எலக்ட்ரான் குறை மூலக்கூறு ஆகும். லூயி காரம் என்பது ஒரு எதிரயனி (அல்லது) குறைந்தபட்சம் ஒரு தனித்த இரட்டை எலக்ட்ரான்களை கொண்ட நடுநிலை மூலக்கூறு ஆகும்.
போரான் ட்ரைபுளூரைடு மற்றும் அம்மோனியா ஆகியவற்றிற்கிடையே நிகழும் வினையை கருதுவோம்.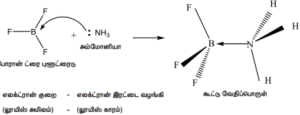
இங்கு, போரான் அணு ஒரு காலியான 2p ஆர்பிட்டாலைக் கொண்டுள்ளது. இது, அம்மோனியாவால் வழங்கப்படும் தனித்த எலக்ட்ரான் இரட்டையை ஏற்றுக்கொண்டு ஒரு புதிய ஈதல் சகப்பிணைப்பை உருவாக்குகிறது. அணைவுச் சேர்மங்களிலுள்ள ஈனிகள், லூயி காரங்களாகவும், ஈனிகளிடமிருந்து தனித்த எலக்ட்ரான் இரட்டைகளை ஏற்றுக்கொள்ளும் மைய உலோக அணு அல்லது அயனியானது லூயி அமிலமாகவும் செயல்படுகிறது என்பதை நாம் முன்னரே கற்றறிந்தோம்.
லூயி அமிலங்கள் | லூயி காரங்கள் |
BF3, AlCl3, BeF2 போன்ற எலக்ட்ரான் குறை மூலக்கூறுகள் | ஒன்று அல்லது அதற்கு மேற்பட்ட தனித்த எலக்ட்ரான் இரட்டைகளை கொண்டுள்ள மூலக்கூறுகள் NH3, H2O, R-O-H, R-O-R, R – NH2 |
அனைத்து உலோக அயனிகள் எடுத்துக்காட்டுகள்: Fe2+, Fe3+, Cr3+, Cu2+ போன்றவை… | அனைத்து எதிரயனிகள் எடுத்துக்காட்டுகள்: F–, Cl–, CN–, SCN–, SO42- போன்றவை… |
ஒரு முனைவுற்ற இரட்டை பிணைப்பை கொண்டுள்ள மூலக்கூறுகள். எடுத்துக்காட்டுகள்: SO2, CO2, SO3 போன்றவை… | கார்பன் – கார்பன் பல்பிணைப்புகளை கொண்டுள்ள மூலக்கூறுகள். எடுத்துக்காட்டுகள்: CH2 =CH2, CH≡ CH போன்றவை… |
காலியான d – ஆர்பிட்டால்களை கொண்டிருப்பதால் தன்னுடைய எண்மத்தை நீட்டிக்கொள்ளும் மைய அணுவை பெற்றுள்ள மூலக்கூறுகள். எடுத்துக்காட்டுகள்: SiF4, SF4, FeCl3 போன்றவை. | அனைத்து உலோக ஆக்சைடுகள் எடுத்துக்காட்டுகள்: CaO, MgO, Na2O போன்றவை… |
கார்பன் நேரயனி (CH3)3 C+ | கார்பன் எதிரயனி CH3− |
பொது அயனி விளைவு:
ஒரு வலிமை குறைந்த அமிலத்தின் உப்பை, அதே அமிலத்துடன் சேர்க்கும்போது, அந்த அமிலத்தின் பிரிகைவீதம் மேலும் குறைகிறது. எடுத்துக்காட்டாக, அசிட்டிக் அமில கரைசலுடன் சோடியம் அசிட்டேட்டை சேர்க்கும்போது, ஏற்கனவே குறைந்தளவு பிரிகையடைந்துள்ள அசிட்டிக் அமிலத்தின் பிரிகை வீதமானது மேலும் குறைக்கப்படுகிறது. இந்நேர்வில், CH3COOH மற்றும் CH3COONa ஆகிய இரண்டும் CH3COO– எனும் பொது அயனியை பெற்றுள்ளன.
இது ஏன் நிகழ்கிறது? என்பதை ஆராய்வோம். அசிட்டிக் அமிலம் ஒரு வலிமை குறைந்த அமிலமாகும். இது நீர்க்கரைசலில் முழுமையாக பிரிகையடைவதில்லை. எனவே, பின்வரும் சமநிலை உருவாகிறது.![]()
எனினும், சேர்க்கப்பட்ட சோடியம் அசிட்டேட் உப்பானது முழுமையாக பிரிகையடைந்து Na+ மற்றும் CH3 COO– அயனிகளை உருவாக்குகின்றன.![]()
எனவே, ஒட்டுமொத்த CH3COO– அயனிச் செறிவு அதிகரிக்கிறது, மேலும், அமில பிரிகையடைதல் சமநிலை பாதிக்கப்படுகிறது. லீ சாட்லியர் கொள்கைப்படி, சமநிலையில் உள்ள ஒரு அமைப்பின்மீது ஏதேனும் ஒரு பாதிப்பினை ஏற்படுத்தும்போது, அந்த சமநிலை அமைப்பானது தன்னைத்தானே சரிசெய்து கொண்டு பாதிப்பின் விளைவை பூஜ்ஜியமாக்கிக் கொள்ளும் என்பது நாமறிந்ததே. எனவே, சமநிலையை பராமரிக்கும் பொருட்டு, அதிகப்படியாக உள்ள CH3COO– அயனிகள் H+ அயனிகளுடன் இணைந்து அதிக அயனியுறா தன்மைகொண்ட CH3COOH ஆக மாறுகிறது. சமநிலையானது இடதுபுறமாக நகருகிறது, CH3COOH அமிலத்தின் பிரிகையாதல் குறைக்கப்படுகிறது. அதாவது, வலிமை குறைந்த மின்பகுளியுடன், ஒரு பொது அயனியை கொண்டுள்ள உப்பை (CH3COONa) சேர்க்கும்போது அந்த வலிமை குறைந்த மின்பகுளியின் (CH3COOH) பிரிகையடைதல் குறைகிறது. இது பொது அயனி விளைவு என்றழைக்கப்படுகிறது.
தாங்கல் கரைசல்:
நமது உடலிலுள்ள இரத்தம், பலவிதமான அமில-கார செல்வினைகளுக்கு நடுவிலும் தன்னுடைய pH மதிப்பை மாறாமல் பராமரிக்கிறது என்பதை நீ அறிவாயா? அத்தகைய வினைகளில் ஹைட்ரோனியம் அயனிச் செறிவை மாறாமல் பராமரிப்பது சாத்தியமா? ஆம், தாங்கல் செயல்முறையின் காரணமாக இது சாத்தியமே.
தாங்கல் கரைசல் என்பது, ஒரு வலிமை குறைந்த அமிலம் மற்றும் அதன் இணைகாரம் (அல்லது) ஒரு வலிமை குறைந்த காரம் மற்றும் இணைஅமிலம் ஆகியவற்றைக் கொண்டுள்ள கரைசல் கலவையாகும். இந்த தாங்கல் கரைசலானது, சிறிதளவு அமிலம் அல்லது காரம் சேர்ப்பதினால் உருவாகும் தீவிர pH மாற்றத்தை தடுக்கிறது. மேலும், இந்த திறனானது தாங்கல் செயல்முறை என்றழைக்கப்படுகிறது. கார்பானிக் அமிலம் (H2CO3) மற்றும் அதன் இணை காரம் HCO3– ஆகியவற்றை கொண்ட தாங்கல் கரைசல் நம் இரத்தத்தில் காணப்படுகிறது. இரண்டு வகையான தாங்கல் கரைசல்கள் உள்ளன. அவையாவன:
- அமில தாங்கல் கரைசல்: ஒரு வலிமை குறைந்த அமிலம் மற்றும் அதன் உப்பு கரைந்துள்ள கரைசல். எடுத்துக்காட்டு: அசிட்டிக் அமிலம் மற்றும் சோடியம் அசிட்டேட் ஆகியவை கரைந்துள்ள கரைசல்
- காரக் தாங்கல் கரைசல்: ஒரு வலிமை குறைந்த காரம் மற்றும் அதன் உப்பு கரைந்துள்ள கரைசல். எடுத்துக்காட்டு: NH4OH மற்றும் NH4Cl ஆகியவை கரைந்துள்ள கரைசல்.
தாங்கல் செயல்முறை:
அமிலம் (அல்லது) காரத்தை சேர்ப்பதினால் உண்டா கும் pH மாற்றத்தை தடுப்பதற்காகவும், சேர்க்கப்படும் அமிலம் அல்லது காரத்தை நடுநிலையாக்குவதற்காகவும், தாங்கல் கரைசலில் அமிலம் மற்றும் காரத்தன்மை கொண்ட சேர்மங்கள் இருத்தல் அவசியம். அதே நேரத்தில் இந்த சேர்மங்கள் ஒன்றுடன் ஒன்று வினைபுரிதல் கூடாது.
CH3COOH மற்றும் CH3COONa ஆகியவற்றைக் கொண்ட கரைசலின் தாங்கல் செயல்முறையை நாம் விளக்குவோம். தாங்கல் கரைசலிலுள்ள கூறுகள் கீழே காண்பிக்கப்பட்டுள்ளவாறு பிரிகையடைகின்றன.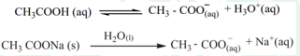
இக்கலவையுடன் அமிலத்தை சேர்க்கும்போது அந்த அமிலமானது, கரைசலிலுள்ள இணைகாரம் CH3COO– உடன் வினைப்பட்டு பிரிகையடையாத வலிமை குறைந்த அமிலமாக மாறுகிறது. அதாவது, H+ அயனிச் செறிவு அதிகரிப்பினால் கரைசலின் pH மதிப்பு பெரியளவு அதிகரிப்பதில்லை.![]()
இக்கலவையுடன் காரத்தைசேர்க்கும்போது அந்த காரமானது, கரைசலிலுள்ள H3O+ அயனிகளால் நடுநிலையாக்கப்படுகின்றன. மேலும், சமநிலையை பராமரிக்க அசிட்டிக் அமிலம் மேலும் சிறிதளவு பிரிகையடைகிறது. எனவே pH மதிப்பில் குறிப்பிட்டளவு மாற்றம் ஏதும் ஏற்படுவதில்லை.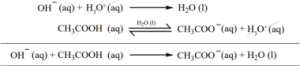
இந்த நடுநிலையாக்க வினைகள், பொது அயனி விளைவில் விவாதிக்கப்பட்ட வினைகளை ஒத்துள்ளன. 0.8M CH3COOH மற்றும் 0.8M CH3COONa கரைந்துள்ள ஒரு லிட்டர்தாங்கல்கரைசலுடன் 0.01 மோல் திண்ம சோடியம் ஹைட்ராக்சைடு சேர்ப்பதினால் உண்டாகும் விளைவை ஆராய்வோம். NaOH சேர்ப்பதினால் உண்டாகும் கனஅளவு மாற்றத்தை ஒதுக்கத்தக்கதாக கருதுக.(கொடுக்கப்பட்டது:CH3COOH அமிலத்தின் Ka மதிப்பு 1.8 × 10-5)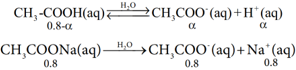
CH3COOH அமிலத்தின் பிரிகை மாறிலி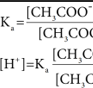
H+ செறிவு ![]() க்கு நேர்விகிதத்திலிருக்கும் என்பதை இந்த சமன்பாடு காட்டுகிறது.
க்கு நேர்விகிதத்திலிருக்கும் என்பதை இந்த சமன்பாடு காட்டுகிறது.
CH3COOH அமிலத்தின் பிரிகை வீதத்தை α எனக் கொண்டால்,
[CH3COOH] =0.8 – α மற்றும் [CH3COO ]= +0.8
CH3COOH ன் Ka மதிப்பு 1.8 X 10-5
∴ [H+] = 1.8 X 10-5 ; pH = – log(1.8 X 10-5)
= 5 – log 1.8
= 5 – 0.26
pH = 4.74
1 லிட்டர் தாங்கல் கரைசலுடன் 0.01 மோல் NaOH ஐ சேர்த்தபின்பு pH ஐ கணக்கிடுதல்.
NaOH சேர்ப்பதினால் உண்டாகும் கன அளவு ஒதுக்கத்தக்கது. ∴[OH–] = 0.01M. OH– அயனிகளின் நுகர்வு பின்வரும் சமன்பாடுகளால் விளக்கப்படுகிறது.
ஒருவலிமைமிகுகாரத்தை (0.01 M NaOH) சேர்ப்பதினால் pHகுறைந்தளவு மட்டுமே அதிகரிக்கிறது. அதாவது 4.74 லிருந்து 4.75 க்கு அதிகரிக்கிறது. எனவே தாங்கல் செயல்முறை சரிபார்க்கப்பட்டது.
கணக்கீடுகள்:
pH என்பது ஹைட்ரஜன் அயனி செறிவின் பத்தை அடிப்படையாக கொண்ட மடக்கையின் எதிர் மதிப்பாகும்.
pH = –log10[H+]
எ.கா: 0.01 M HNO3 கரைசலின் pH மதிப்பு காண்க.
தீர்வு
[H+] = 0.01
pH = –log10 [H+]
pH = –log10 [0.01]
pH = –log10 [1 × 10-2 ]
pH = –(log101 – 2 log1010)
pH = 0 + 2 × log1010
pH = 0 + 2 × 1 = 2 pH = 2
pOH என்பது ஹைட்ரா க்சில் அயனிச் செறிவின் பத்தை அடிப்படையாக கொண்ட மடக்கையின் எதிர் மதிப்பாகும்.
pOH = –log10[OH–]
எ.கா: ஒரு கரைசலின் ஹைட்ராக்சில் அயனி செறிவு 1 x 10-9 M எனில் அக்கரைசலின் pOH மதிப்பு என்ன?
pOH = –log10 [OH– ]
pOH = –log10 [1 × 10-9]
pOH = –(log10 1.0 + log10 10-9 )
pOH = –(0–9 log1010)
pOH = –(0 – 9)
pOH = 9
pH மற்றும் pOH க்கு உள்ள தொடர்பு
ஒரு நீர்க்கரைசலின் pH மற்றும் pOH-க்கு இடையேயான தொடர்பை கீழ்க்கண்ட சமன்பாட்டின் மூலம் அறியலாம்.
pH + pOH = 14
கரைசலின் pH மற்றும் pOH ல் ஏதேனும் ஒரு மதிப்பு தெரிந்தால் மற்றொன்றை எளிதாக கணக்கிடலாம்.
எ.கா ஒரு கரைசலின் pOH மதிப்பு 11.76 எனில் அக்கரைசலின் pH மதிப்பு காண்க.
pH = 14 – pOH
pH = 14 – 11.76 = 2.24
கணக்குகள்
எ.கா: 1
0.001 M செறிவுள்ளஹைட்ரோ குளோரிக் அமிலத்தின் கரைசலின் pH மதிப்பை காண்க.
தீர்வு:
HCl என்பது வலிமை மிகுந்த அமிலம் என்பதால் முழுவதும் அயனியாக மாறும் கீழ்கண்டவாறு.![]()
மேற்கண்ட செயலில் ஒரு மோல் HCl ஒரு மோல் H+ அயனிகளை தரும். ஆகையால், H+ அயனியின் செறிவானது ஹைட்ரோ குளோரிக் (HCl) அமில செறிவுக்கு சமம். (0.001 M அல்லது 1.0 x 10-3 மோல் லி-1.)
pH = –log10[H+] = –log1010–3
= –(–3 × log10)
= –(3 × 1) = 3
pH = 3
எ.கா: 2
5 x 10-5 மோல்-1 செறிவு கொண்ட நீர்த்த சல்பியூரிக் அமிலத்தின் pH மதிப்பு என்ன?
தீர்வு:
நீரில், சல்பியூரிக் அமிலம் பிரியும் முறை![]()
கரைசலில் ஒவ்வொரு மோல் சல்பியூரிக் அமிலம், இரண்டு மோல் H+ அயனிகளை தரும். ஒரு லிட்டர் H2SO4 கரைசலில் 5 x 10-5 மோல் H2SO4 இருக்கும். 2 x 5 x 10-5 = 10 x 10-5 அல்லது H+ அயனிகளை ஒரு லிட்டரில் 1.0 x 10-4 மோல்.
[H+ ] = 1.0 × 10–4 மோல் லிட்டர்–1
pH = –log10[H+]
= –log1010–4
= –(–4 × log1010)
= –(–4 × 1) = 4
pH = 4
எ.கா: 3
1 x 10-4 மோல் NaOH கரைசலில் உள்ள pH மதிப்பை காண்க.
தீர்வு:
NaOH என்பது வலிமையான காரம் மற்றும் அக்கரைசலை கீழ்கண்டவாறு பிரிகை அடைகிறது.![]()
ஒரு மோல் NaOH ஆனது ஒரு மோல் OH– அயனிகளை இதிலிருந்து தரும்.
[OH–] = 1 × 10–4 மோல் லிட்டர்–1
pOH = –log10[OH–]
= –log10 × [10–4]
= –(–4 × log1010)
= –(–4) = 4
pH + pOH = 14
pH = 14 – pOH
= 14 – 4
= 10
எ.கா: 4
ஒரு கரைசலின் ஹைட்ரஜன் அயனியின் செறிவு 1 x 10-8 மோல் லி-1 எனில் அக்கரைசலின் pH மதிப்பை காண்க. தீர்வு இங்கு நீர்த்த கரைசலாக உள்ளதால் கொடுக்கப்ப ட்டுள்ள செறிவானது அமிலத்தையோ, காரத்தையோ குறிப்பது இல்லை. ஆனால் H+ அயனிகளை குறிக்கும். எனவே கீழ்கண்டவாறு கணக்கிடலாம்.
தீர்வு:
pH = –log10[H+]
[H+] = 1.0 × 10–8 மோல் லிட்டர்–1
pH = –log1010–8
= –(–8 × log1010)
= –(–8 × 1) = 8
எ.கா: 5
ஒரு கரைசலின் pH மதிப்பு 4.5 எனில் pOH மதிப்பைக் காண்க.
தீர்வு:
pH + pOH = 14
pOH = 14 – pH
pOH = 14 – 4.5 = 9.5
pOH = 9.5
