ஆக்ஸிஜனேற்றம் மற்றும் ஒடுக்கம்
ஆக்ஸிஜனேற்றம், ஒடுக்கம் மற்றும் ஆக்ஸிஜனேற்ற ஒடுக்க வினைகள்
ஒரு ஆப்பிள் பழத்தை வெட்டி சிறிது நேரம் வைத்திருந்தால் அதன் வெட்டுப்பரப்பு பழுப்பு நிறமாக மாறுவதைக் காணலாம். அதைப்போலவே இரும்புப் பொருள்களில் துருப்பிடித்தலை அன்றாட வாழ்வில் காண்கிறோம். இத்தகைய நிகழ்வுகள் ஏன் நிகழ்கின்றன எனத் தெரியுமா? இவைநிகழக்காரணம் ஆக்ஸிஜனேற்றம் எனும் வினை ஆகும்.
ஆக்ஸிஜனேற்றம்: ஒரு வேதிவினையில் ஆக்ஸிஜன் சேர்க்கப்படுதலோ, ஹைட்ரஜன் நீக்கப்படுதலோ அல்லது எலக்ட்ரான்கள் நீக்கப்படுதலோ நிகழும் போது அந்த வினை ஆக்ஸிஜனேற்றம் எனப்படுகிறது.
ஒடுக்கம்: ஒரு வேதிவினையில் ஹைட்ரஜன் சேர்க்கப்படுதலோ, ஆக்ஸிஜன் நீக்கப்படுதலோ அல்லது எலக்ட்ரா ன் ஏற்கப்படுதலோ நிகழும் போது அந்த வினை ஒடுக்கம் எனப்படுகிறது.
ஆக்ஸிஜனேற்ற ஒடுக்க வினைகள்: பொதுவாக, ஒரு வினையில் ஆக்ஸிஜனேற்றமும் ஒடுக்கமும் ஒரே நேரத்தில் நிகழ்கின்றன. ஒரு வினைபடு பொருள் ஆக்ஸிஜனேற்றம் அடையும் போது மற்றொன்று ஒடுக்கமடைகிறது. எனவே, இவ்வகையான வினை கள் ஆக்ஸிஜனேற்ற – ஒடுக்க வினைகள் எனப்படுகின்றன.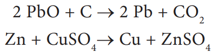
ஆக்ஸிஜனேற்றம் | ஆக்ஸிஜனை சேர்த்தல் |
ஹைட்ரஜனை நீக்குதல் | |
எலக்ட்ரானை இழத்தல் | |
ஒடுக்கம் | ஹைட்ரஜனை சேர்த்தல் |
ஆக்ஸிஜனை நீக்குதல் | |
எலக்ட்ரானை ஏற்றல் |
ஆக்ஸிஜனேற்றி மற்றும் ஒடுக்கிகள்
மற்ற பொருள்களை ஆக்ஸிஜனேற்றம் அடையச் செய்யும் பொருள்கள் ஆக்ஸிஜனேற்றிகள் எனப்படும். இவை மற்றவற் றிடமிருந்து எலக்ட்ரானை வாங்கிக்கொள்வதால் இவற்றை எலக்ட்ரான் ஏற்பிகள் எனவும் அழைக்கிறோம்.
எ.கா: H2 O2 , MnO4 − , CrO3 , Cr2 O7 2−
மற்ற பொருள்களை ஒடுக்கம் அடையச் செய்யும் பொருள்கள் ஒடுக்கிகள் எனப்படும். இவை மற்றவற்றிற்கு எலக்ட்ரானை வழங்குவதால் இவற்றை எலக்ட்ரா ன் ஈனிகள் எனவும் அழைக்கிறோம்.
எ.கா : NaBH4 , LiAlH4 மற்றும் பல்லேடியம், பிளாட்டினம் போன்ற உலோகங்கள்
அன்றாட வாழ்வில் ஆக்ஸிஜனேற்ற வினைகள்
இயற்கையில் காற்றில் காணப்படும் ஆக்ஸிஜனானது, உலோகங்கள் முதல் உயிருள்ள திசுக்கள் வரை பலவற்றை ஆக்ஸினேற்றம் அடையச் செய் கிறது.
- பளபளக்கும் உலோகங்கள், காற்றிலுள்ள ஆக்ஸிஜனுடன் வினைபுரிந்து உலோக ஆக்ஸைடுகளாக மாறுவதால் தங்களின் பளபளப்பை இழக்கின்றன. இதற்கு உலோகங்களின் அரிமானம் (Corrosion) என்று பெயர்.
- புதிதாக வெட்டப்பட்ட காய்கறிகளும், பழங்களும் சிறிது நேரத்தில் நிறம் மாறுவது, அவற்றிலுள்ள நொதிகள் ஆக்ஸிஜனேற்றம் அடைவதால் உண்டாவதாகும்.
- திறந்து வைக்கப்பட்ட உணவுப்பொருள்கள் கெட்டுப்போவதற்கு (Rancidity) அப்பொருள்கள் ஆக்ஸிஜனேற்றம் அடைதலே காரணமாகும்.
ஆக்ஸிஜனேற்ற எண்
ஒரு வேதிவினையின் போது ஒரு தனிமத்திலுள்ள அணுவானது இழக்கின்ற அல்லது ஏற்கின்ற எலக்ட்ரான்களின் எண்ணிக்கையே அவ்வணுவின் ஆக்சிஜனேற்ற எண் எனப்படும். ஆக்ஸிஜனேற்ற எண் என்பதை ஆக்ஸிஜனேற்ற நிலை எனவும் அழைக்கிறோம். ஒரு அணுவானது எலக்ட்ரானை இழப்பதால் நேர் ஆக்சிஜனேற்ற எண்ணையும், எலக்ட்ரானை ஏற்பதால் எதிர் ஆக்சிஜனேற்ற எண்ணையும் பெறுகிறது. அது எலக்ட்ரானை ஏற்கவோ அல்லது இழக்கவோ இல்லையெனில் அதன் ஆக்சிஜனேற்ற எண் பூஜ்யம். ஒரு மூலக்கூறில் உள்ள அனைத்து அணுக்களின் ஆக்ஸிஜனேற்ற எண்களின் கூடுதல் பூஜ்யமாகும். அயனிகளைப் பொறுத்த வரையில் இக்கூடுதல் மதிப்பு அயனிகளின் மீதுள்ள நிகர மின்சுமைக்குச் சமம். சேர்மங்களில் அதிக எலக்ட்ரான் கவர் தன்மை உள்ள அணு எதிர் ஆக்ஸிஜனேற்ற எண்ணையும், குறைந்த எலக்ட்ரான் கவர் தன்மை கொண்ட அணு நேர் ஆக்ஸிஜனேற்ற எண்ணையும் பெறும்.
எடுத்துக்காட்டு:
- KBr மூலக்கூறில் உள்ள K அணு +1 ஆக்ஸிஜனேற்ற எண்ணையும், Br அணு -1 ஆக்ஸிஜனேற்ற எண்ணையும் பெறுகிறது.
- NH3 மூலக்கூறில் உள்ள N ன் ஆக்ஸிஜனேற்ற எண் -3
- H ன் ஆக்ஸிஜனேற்ற எண் +1 (உலோக ஹைட்ரைடுகள் தவிர)
- பெரும்பாலான சேர்மங்களில் ஆக்ஸிஜனின் ஆக்ஸினேற்ற எண் -2
ஆக்ஸிஜனேற்ற எண்ணை நிர்ணயித்தல் – கணக்கீடுகள்:
ஒரு நடுநிலையான மின்சுமையற்ற மூலக்கூறின் ஆக்ஸிஜனேற்ற எண் பூஜ்ஜியமாகும்.
விளக்கம் 1:
H2O ல் உள்ள H மற்றும் Oன் ஆக்ஸிஜனேற்ற எண்
H – ன் ஆக்ஸினேற்ற எண் = +1 எனவும், O – ன் ஆக்ஸினேற்ற எண் = – 2 எனவும் கொள்வோம்.
H2O ல்
2 × (+1) + 1 × (-2) = 0
2 – 2 = 0
எனேவ, Hன் ஆ.எண்: +1, Oன் ஆ.எண்: -2
விளக்கம் 2:
H2 SO4 ல் உள்ள S ன் ஆக்ஸிஜனேற்ற எண்
H – ன் ஆக்ஸிஜனேற்ற எண் = +1
O – ன் ஆக்ஸிஜனேற்ற எண் = -2
S – ன் ஆக்ஸிஜனேற்ற எண் = x என்க
எனவே, H2 SO4 – ல்
2 × (+1) + (+1) + x + 4x(-2) = 0
(+2) + x + (-8) = 0
x = +6
ஃ S ன் ஆக்ஸிஜனேற்ற எண் = +6
விளக்கம் 3:
K2 Cr2 O7 – ல் உள்ள Cr ன் ஆக்ஸிஜனேற்ற எண்
K – ன் ஆக்ஸிஜனேற்ற எண் = +1
O – ன் ஆகஸிஜனேற்ற எண் = -2
Cr – ன் ஆக்ஸிஜனேற்ற எண் = x என்க
எனவே, K2 Cr2 O7 – ல்
2 × (+1) + 2 × (x) + 7 × (-2) = 0
(+2) + 2x + (-14) = 0
2x = 12
x = 6
ஃ Cr ன் ஆக்ஸிஜனேற்ற எண் = +6
விளக்கம் 4:
FeSO4 – ல் உள்ள Fe ன் ஆக்ஸிஜனேற்ற எண்
O – ன் ஆக்ஸிஜனேற்ற எண் = -2
S – ன் ஆக்ஸிஜனேற்ற எண் = +6
Fe – ன் ஆக்ஸிஜனேற்ற எண் = x என்க.
எனவே, FeSO4 – ல்
x + (+6) + 4 × (-2) = 0
x + 6 – 8 = 0
x = +2
ஃ Fe ன் ஆக்ஸிஜனேற்ற எண் = +2
கணக்கீடுகள்
- KMnO4 ல் உள்ள Mn ன் ஆக்ஸிஜனேற்ற எண்ணைக் காண்க.
- Na2 Cr2 O7 ல் உள்ள Cr ன் ஆக்ஸிஜனேற்ற எண்ணைக் காண்க.
- CuSO4 ல் உள்ள Cu ன் ஆக்ஸிஜனேற்ற எண்ணைக் காண்க.
- FeO ல் உள்ள Fe ன் ஆக்ஸிஜனேற்ற எண்ணைக் காண்க.
ஹீமோகுளோபின் மற்றும் ஆக்சிஜன் கடத்தல்
காற்றில் சிறிதளவு ஆக்சிஜன் இருந்தாலும் அது இரும்பை துருப்பிடிக்கச் செய்கிறது – அதாவது இரும்பானது Fe3+ ஆக ஆக்சிஜனேற்றமடைகிறது. ஆனால், நுரையீரலிலிருந்து ஆக்சிஜனை Fe2+ மூலம் பிணைத்து உடலின் அனைத்து திசுக்களுக்கும் ஆக்சிஜனை கொண்டு செல்லும் ஹீமோகுளோபினில் உள்ள Fe2+ துருபிடிப்பதில்லை. இதற்கு காரணம் என்னவென்று தங்களுக்குத் தெரியுமா?
இதற்கான பதில், ஹிமோகுளோபினின் வடிவமைப்பில் உள்ளது. நான்கு துணை அலகுகள் உள்ளன. ஒவ்வொரு அலகும் பார்பைரின் வளையத்தை (ஹீம்) உள்ளடக்கியது. ஹீம் ஆனது புரோட்டீன் சங்கிலியுடன் (குளோபின்) இணைக்கப்பட்டுள்ளது. இந்த வடிவமைப்பானது Fe2+ ஐ மையத்தில் கொண்ட எண்முகி வடிவமைப்பாகும். இதன் நான்கு நிலைகள் பார்பைரின் வளையத்துடனும், ஐந்தாவது நிலை ஹிஸ்டிடினின் இமிடசோல் வளையத்துடனும் இணைக்கப்பட்டுள்ளது. ஆறாவது நிலையானது ஆக்சிஜனை பிணைக்கப் பயன்படுகிறது. பொதுவாக, ஹீமில் உள்ள Fe2+ ஆனது எளிதில் ஆக்சிஜனேற்றம் அடையக்கூடியது. Fe2+ஐ சூழ்ந்துள்ள குளோபின் புரோட்டீன் சங்கிலியானது நீர் வெறுக்கும் சூழலைத் தருவதால், Fe2+ ஆச்சிஜனேற்றம் அடைவது கடினமானதாகிறது. எனினும் நாள்தோறும் 3% ஹீமோகுளோபின் மெத்திமோ குளோபினாக (ஹீமோகுளோபினில் உள்ள இரும்பு Fe3+ ஆக காணப்படுகிறது) ஆக்சிஜனேற்றம் அடைகிறது. மெத்திமோ குளோபின் ரிடெக்டேஸ் நொதி அதனை மீண்டும் ஹீமோகுளோபினாக ஒடுக்கமடைய செய்கிறது.
சயனைடு நச்சுத்தன்மை:
ஆக்சிஜன் ஹீமோகுளோபினுடன் மீள் முறையில் பிணைக்கப்படுகிறது, ஆனால் சயனைடு ஆனது மீளா முறையில் பிணைந்து, ஹீமோகுளோபினுடன் ஆக்சிஜன் பிணைக்கப்படுதலை தடுக்கிறது. இதனால் நுரையீரலிலிருந்து, திசுக்களுக்கு, ஆக்சிஜன் கடத்தப்படுவது நிறுத்தப்படுகிறது. இதன் காரணமாக சயனைடு உட்கொண்டவர் விரைவாக மரணமடைகிறார்.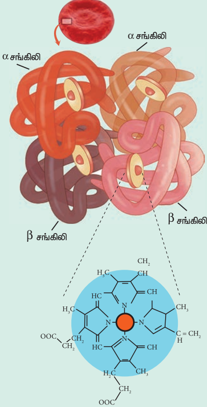
ஆக்சிஜனேற்ற – ஒடுக்க வினைகளின் வகைகள்
ஆக்சிஜனேற்ற – ஒடுக்க வினைகளை பின்வருமாறு வகைப்படுத்தலாம்.
- இணையும் வினைகள்: (Combination reactions):
இரண்டு வினைப் பொருட்கள் வினைபுரிந்து ஒரு சேர்மத்தினைத் தரும் ஆக்சிஜனேற்ற-ஒடுக்கவினைகள், இணையும் வினைகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டு: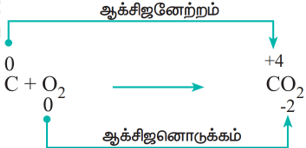
- சிதைவடையும் வினைகள் (Decomposition reactions)
ஒரு சேர்மம், இரண்டு அல்லது அதற்கு மேற்பட்ட கூறுகளாக சிதைவடையும், ஆக்சிஜனேற்ற ஒடுக்க வினைகள் சிதைவடையும் வினைகள் என அழைக்கப்படுகின்றன. இவ்வினைகள் இணையும் வினைகளுக்கு நேர்மாறானவை. இவ்வகை வினைகளில், ஒரு சேர்மத்தில் உள்ள இரண்டு வெவ்வேறான தனிமங்களின் ஆக்சிஜனேற்ற எண்களில் மாற்றம் ஏற்படுகிறது.
எடுத்துக்காட்டு: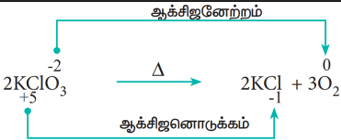
- இடப்பெயர்ச்சி வினைகள் (Displacement reactions)
ஆக்சிஜனேற்ற – ஒடுக்க வினைகளின் போது, ஒரு சேர்மத்தில் உள்ள ஒரு அணு அல்லது அயனி மற்றொரு அணு அல்லது அயனியால் பதிலீடு செய்யப்பட்டால் அத்தகைய வினைகள் இடப்பெயர்ச்சி வினைகள் எனப்படுகின்றன. இவ்வினைகளை மேலும் i) உலோக இடப்பெயர்ச்சி வினைகள் ii) அலோக இடப்பெயர்ச்சி வினைகள் என வகைப்படுத்தலாம்.
(i) உலோக இடப்பெயர்ச்சி வினைகள்:
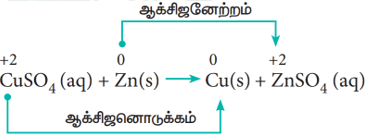
ஒரு கண்ணாடி கலனில் நீர்த்த தாமிர சல்பேட் (Copper Sulphate) கரைசலை எடுத்துக் கொண்டு, அதில் துத்தநாக (Zinc) உலோக தகட்டினை வைக்கவும். கரைசலை உற்று நோக்கவும். கரைசலின் அடர் நீல நிறத்தின் செறிவு மெதுவாக குறையத்துவங்கும். இறுதியில் நிறம் முற்றிலும் மறைந்துவிடும். துத்தநாக உலோகத் தகட்டின் மீது பழுப்பு நிற தாமிர உலோகம் படிந்திருப்பதைக் காணலாம். இந்நிகழ்வு நடைபெற பின்வரும் உலோக இடப்பெயர்ச்சி வினை காரணமாக அமைகிறது.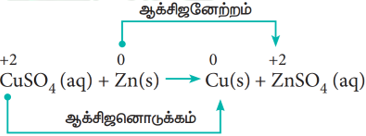
- ii) அலோக இடப்பெயர்ச்சி வினைகள்:
நீர்த்த HCI கரைசலுடன் துத்தநாக துகள்களை சேர்க்கும்போது HCI ல் இருந்து துத்தநாகம் ஹைட்ரஜனை இடப்பெயர்ச்சி செய்கிறது.
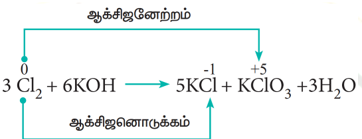
- விகிதச்சிதைவு வினைகள் (Disproportionation reactions)
சில ஆக்சிஜனேற்ற – ஒடுக்க வினைகளில், ஒரே சேர்மம், ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜனொடுக்கம் இரண்டிற்கும் உட்படுகிறது. இத்தகைய வினைகளில், ஒரே தனிமத்தின் ஆக்சிஜனேற்ற எண் அதிகரிக்கவும், குறையவும் செய்கிறது. இத்தகைய வினைகள் விகிதச்சிதைவு வினைகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டு: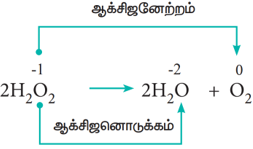
- எலக்ட்ரான் பரிமாற்றத் திறன் (Competitive electron transfer reactions)
தாமிர சல்பேட் கரைசலிலிருந்து, தாமிரத்தை, துத்தநாகம் இடப்பெயர்ச்சி செய்வதை உலோக இடப்பெயர்ச்சி வினைகளில் நாம் கற்றறிந்தோம். இதன் எதிர்வினை நிகழ வாய்ப்புள்ளதா? என்பதை நாம் சோதித்து அறிவோம். முன்னரே விளக்கிய செயல்முறைப்படி, துத்தநாக சல்பேட் கரைசலை ஒரு கலனில் எடுத்துக் கொண்டு, தாமிர தகட்டினை அக்கரைசலில் வைக்கவும். தாமிரமானது, துத்தநாக சல்பேட் கரைசலிலிருந்து, துத்தநாகத்தை இடப்பெயர்ச்சி செய்திருக்குமாயின், Cu2+ அயனிகள்கரைசலில் இருந்திருக்க வேண்டும். இதன் விளைவாக கரைசல் நீல நிறமாக மாற்றமடைந்திருக்க வேண்டும். ஆனால், இத்தகைய மாற்றங்கள் ஏதும் நிகழ்வதில்லை. எனவே, தாமிரம் மற்றும் துத்தநாகம் ஆகிய இரண்டினையும் ஒப்பிடும்போது, துத்தநாகமானது எலக்ட்ரானை இழக்கும் தன்மையினையும், தாமிரமானது எலக்ட்ரானை ஏற்கும் தன்மையினையும் பெற்றுள்ளது என்று நாம் முடிவு செய்யலாம்.
மேற்கண்டுள்ளவாறு வெள்ளி நைட்ரேட் (Silver Nitrate) கரைசலில், தாமிர தகட்டினை வைத்து வினை ஏதேனும் நிகழ்கிறதா என பார்ப்போம். சிறிது நேரம் கழித்த பின்னர், கரைசல் மெதுவாக நீல நிறமாக மாறத்துவங்கும். Cu2+ அயனிகள் உருவாவதே இதற்கு காரணமாகும்.
அதாவது, வெள்ளி நைட்ரேட் கரைசலில் உள்ள வெள்ளியை, தாமிரம் இடப்பெயர்ச்சி செய்கிறது.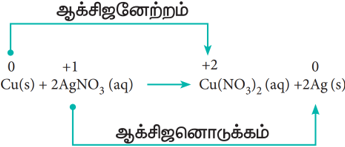
தாமிரம்மற்றும் வெள்ளி ஆகியவற்றிக்கு இடையே வினைத்திறனை ஒப்பிடும்போது, தாமிரம் எலக்ட்ரானை இழக்கும் தன்மையினையும், வெள்ளி எலக்ட்ரானை ஏற்கும் தன்மையினையும் பெற்றுள்ளதை மேற்கண்டுள்ள வினை உணர்த்துகிறது.
மேற்கண்டுள்ள சோதனை முடிவுகளிலிருந்து, துத்தநாகம், தாமிரம் மற்றும் வெள்ளி ஆகிய உலோகங்களுக்கிடையே ஒப்பிடும் போது, எலக்ட்ரானை வெளியிடும் திறன் பின்வரும் வரிசையில் அமைந்துள்ளது என நாம் முடிவு செய்யலாம்.
துத்தநாகம் > தாமிரம் > வெள்ளி
உலோகங்களுக்கு இடையேயான, எலக்ட்ரான்களை பெறுவதில் உள்ள மேற்கண்டுள்ள தன்மையானது, கால்வானிக் மின் கலன்களை வடிவமைப்பதில் நமக்கு பயனுள்ளதாக உள்ளது. கால்வானிக் மின்கலன்களைப் பற்றி XII ம் வகுப்பில் விரிவாக கற்போம்.
இரைப்பை அமிலம் மற்றும் – அமில நீக்கிகள்
அமிலத்தன்மை மற்றும் நெஞ்செரிச்சலை குணப்படுத்த பொதுவாக அமிலநீக்கிகள் மருந்தாக பயன்படுத்தப்படுகிறது. இதன் வேதியியல் உங்களுக்குத் தெரியுமா?
இரைப்பை அமிலம் என்பது வயிற்றில் சுரக்கும் சீரணத்திரவம் ஆகும். இதில், ஹைட்ரோகுளோரிக் அமிலம் உள்ளது. இரைப்பை அமிலத்தில் உள்ள ஹைட்ரோகுளோரிக் அமிலத்தின் செறிவு பொதுவாக 0.082 M என்ற அளவில் இருக்கும். இந்த அமிலத்தின் செறிவு 0.1 M என்ற அளவை விட அதிகமாகும் போது அமிலத்தன்மை மற்றும் நெஞ்செரிச்சல் ஏற்படுகிறது.
அமிலத்தன்மையினைக் குணப்படுத்த பயன்படுத்தப்படும் அமிலநீக்கிகள் பெரும்பாலானவற்றில் மெக்னீசியம் ஹைட்ராக்ஸைடு மற்றும் அலுமினியம் ஹைட்ராக்ஸைடு அடங்கியுள்ளது. இவை அதிகப்படியான -அமிலத்தை நடுநிலையாக்குகிறது. வேதிவினைகள் பின்வருமாறு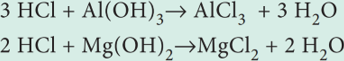
மேற்கண்டுள்ள வினைகளிலிருந்து, 1 மோல் அலுமினியம் ஹைட்ராக்ஸைடு 3 மோல் HCI ஐயும், 1 மோல் மெக்னீசியம் ஹைட்ராக்ஸைடு 2 மோல் HCI ஐயும் நடுநிலையாக்குகிறது என நாம் அறிகிறோம். 250mg அலுமினியம் ஹைட்ராக்ஸைடு மற்றும் 250mg மெக்னீசியம் ஹைட்ராக்ஸைடை கொண்டுள்ள ஒரு அமில நீக்கியால் நடுநிலையாக்கப்படும், அமிலத்தின் அளவினை நாம் கணக்கிடுவோம்.
செயல்படும் சேர்மம் | நிறை(mg)ல்
| மூலக்கூறு நிறை | செயல்படும் சேர்மத்தின் மோல்களின் எண்ணிக்கை | OH –அயனியின் மோல்களின் எண்ணிக்கை |
Al(OH)3 | 250 | 78 | 0.0032 | 0.0096 |
Mg(OH)2 | 250 | 58 | 0.0043 | 0.0086 |
ஒரு மாத்திரையில் உள்ள மொத்த OH –அயனியின் மோல்கள் | 0.0182 | |||
ஒருவருடைய வயிற்றில் 0.1 மோல் அமிலக்கூறைக் கொண்டுள்ள இரைப்பை திரவம் இருப்பின், மேற்கண்டுள்ள இயைபினைப் பெற்றுள்ள ஒரு மாத்திரை ஆனது0.0182மோல் HClஐநடுநிலையாக்கும். அதாவது, ஒரு மாத்திரையானது, அதிகப்படியாக உள்ள அமிலத்தினை நடுநிலையாக்கி (0.1 – 0.018 M = 0.082 M) வழக்கமான அமில நிலைக்கு மீள கொண்டு வரும்.
கார்பன் மற்றும் நைட்ரஜன் சேர்மங்கள்
- கனிம கார்பன் சேர்மங்கள்
சேர்மங்கள் | உருவாக்கம் | பண்புகள் | பயன்கள் |
கார்பன் மோனாக்சைடு (CO) | காற்றில் இயற்கையாக காணப் படும் பகுதிப்பொருள் அல்ல. எரிபொருட்கள் முழுவதுமாக எரியாததால் வளிமண்டலத்தில் சேர்க்கப்படுகின்றது. | நிறமற்றது. மணமற்றது. அதிக நச்சுத்தன்மை உடையது. நீரில் பகுதியளவு கரையும். | நீர் வாயுவின் (CO+H2) முக்கிய பகுதிப்பொருள் மற்றும் ஒடுக்கும் காரணி. |
கார்பன் டைஆக்சைடு (CO2) | இயற்கையில் தனித்த மற்றும் இணைந்த நிலையில் உள்ளது. இணைந்த நிலையில் சுண்ணாம்புக்கல் மற்றும் மேக்னசைட் ஆகியவற்றில் காணப்படுகின்றது. கார்பன் அல்லது கல்கரியானது முழுவதுமாக எரிவதால் உருவாகிறது. | நிறமற்றது. மணமற்றது. சுவையற்றது. நிலையானது. நீரில் அதிக அளவு கரையக் கூடியது. ஒளிச் சேர்க்கையில் ஈடுபடுகிறது. | தீயணைப்பான், பழங்களைப் பாதுகாத்தல், ரொட்டி தயாரித்தல், யூரியா, சோடாபானம், நைட்ரஜன் உரங்கள் மற்றும் குளிர்சாதனப் பெட்டியில் உலர் பனிக்கட்டியாக. |
கால்சியம் கார்பைடு (CaC2) | கால்சியம் ஆக்சைடு (CaO) மற்றும் கல்கரியை வெப்பப்படுத்தும் போது உருவாகிறது. | சாம்பல் கலந்த கருப்பு நிற திண்மம். | கிராபைட் ஹைட்ரஜன் தயாரித்தல், மற்றும் வெல்டிங் தொழிலில் பயன்படும் அசிட்டிலீன் வாயு தயாரித்தல். |
கார்பன் டைசல்பைடு (CS2) | நேரடியாக கார்பன் மற்றும் கந்தகத்திலிருந்து தயாரிக்கப்படுகின்றது. | நிறமற்றது தீப்பற்றக்கூடியது அதிக நச்சுத்தன்மை உடையது. | கந்தக கரைப்பான், ரேயான் தயாரித்தல், மற்றும் பூஞ்சைக் கொல்லி, பூச்சிக் கொல்லி |
கால்சியம் கார்பனேட் (CaCO3) | கார்பன் டைஆக்சைடு (CO2) வாயுவை நீர்த்த சுண்ணாம்புக் கரைசலில் செலுத்தும் போது தயாரிக்கப்படுகின்றது. | படிகவடிவமுடைய திண்மம். நீரில் கரைவதில்லை. | அமில நீக்கி |
சோடியம் பைகார்பனேட் (NaHCO3) | சோடியம் ஹைட்ராக்சைடு (NaOH) மற்றும் கார்பானிக் அமிலத்துடன் (H2CO3) சேர்ந்து உருவாகின்ற து. | வெண்ணிற படிக வடிவமுடைய திண்மம். நீரில் பகுதியளவு கரையக் கூடியது. | சோடியம் கார்பனேட் தயாரித்தல். ரொட்டிசோடா மற்றும் அமில நீக்கி தயாரித்தலில். |
- அன்றாட வாழ்வில் கார்பன் சேர்மங்கள்
கார்பன் சேர்மங்கள் இல்லாத அன்றாட வாழ்க்கையை நம்மால் நினைத்துக் கூட பார்க்க இயலாது. நமது வாழ்க்கை முறையை முன்னேற்றவும், நமது வசதிக்காவும், அதிக எண்ணிக்கையிலான கார்பன் சேர்மங்கள் உருவாக்கப்பட்டுள்ளன. இவற்றுள் கார்பன் சார்ந்த எரிபொருள்கள், கார்பனின் நானோபொருள்கள், நெகிழிகள், கார்பன் வடிப்பா ன் மற்றும் கார்பன் எஃகு போன்றவை அடங்கும்.
கார்பன் மற்றும் அவற்றின் சேர்மங்கள் நவீன வாழ்க்கைக்கு அவசியமானதாக இருந்தாலும், CO, சயனைடு மற்றும் ஒருசில நெகிழி வகைகள் போன்றவை மனிதர்களுக்கு தீமை விளைவிக்கக் கூடியவையாகும். பின்வரும் பாடப்பகுதியில், நம் அன்றாட வாழ்வில் நெகிழியின் பங்கு மற்றும் சில நெகிழிகளில் காணப்படும் நச்சுத்தன்மை வாய்ந்த வேதிப்பொருட்களைப் பற்றிய விழிப்புணர்வை நாம் எப்படி அடைய முடியும் என்பது பற்றி காணலாம்.
- நெகிழிகள் – நீண்ட சங்கிலித் தொடராக்கத்தினாலான கார்பன் சேர்மங்கள்
நெகிழிகள் என்பவை சங்கிலித் தொடராக்கத்தினாலான கரிமச் சேர்மங்களின் ஒரு வகை ஆகும். இவை பலபடி ரெசின்கள் எனப்படும் நீண்ட நெடிய சங்கிலித் தொடராலான கரிமச் சேர்மங்களுடன் தங்களுக்கென்று சில வேறுபட்ட பண்புகளைத் தரும் சில வேதிச்சேர்க்கைகளைச் (additive) சேர்த்து, உருவாக்கப்படுகின்றன. பலவகைப்பட்ட பலபடி ரெசின்கள் பலவகையான நெகிழி தயாரிப்பில் பயன்படுகின்றன. நெகிழிகள் எங்கும் நிறைந்து காணப்படுகின்றன. அவை பயன்படுத்துவதற்கு ஏற்றதாகவும், மலிவாகவும் உள்ளன; மற்றும் நமது அன்றாட வாழ்விலும் பயன்படுத்தப்ப டுகின்றன. நாம் வாழும் வாழ்க்கையை நெகிழிகள் மாற்றியுள்ளன. நமது உடல்நலம், போக்குவரத்து மற்றும் உணவுப்பா துகாப்பு போன்றவற்றை மேம்படுத்த அவை நமக்கு உதவுகின்றன. கைபேசி, கணினி மற்றும் இணையம் போன்றவற்றில் மிகப்பெ ரிய மாற்றங்களை நெகிழிகள் உருவாக்கியுள்ளன. நெகிழிகள் நமது சமூகத்திற்கு அநேக நன்மைகளை வழங்கியுள்ளன என்பது தெளிவாக உள்ளது. ஆனால் இந்த நன்மைகளுடன் சேர்ந்து ஒருசில பாதிப்புகளும் ஏற்படுகின்றன.
நெகிழியின் குறைகள்
- நெகிழிகள் இயற்கையாக சிதைவடைவதற்கு நீண்ட நெடு நாள்களாகும்.
- நெகிழிகளை சிதைவடையச் செய்யும் இயற்கையிலுள்ள நுண்ணுயிர்களின் எண்ணிக்கையானது, நாம் உருவாக்கும் நெகிழிகளின் எண்ணிக்கையை விட குறைவு.
- நாம் பயன்படுத்தும் நெகிழிகளில் பல மறுசுழற்சி செய்ய முடியாதவை; மேலும் அவை நமது சுற்றுப்புறத்தை மாசு படுத்துகின்றன.
- சில நெகிழி வகைகள் நமது உடல் நலனுக்கு கேடு விளைவிக்கும் வேதியியல் சேர்க்கைகளைக் கொண்டுள்ளன.
- நெகிழிகளை எரிப்பது, நமது உடலுக்குத் தீங்கு விளைவிக்கும் நச்சுத் தன்மையுடைய வாயுக்களை வெளியேற்றுவதோடு பருவநிலை மாற்றங்களையும் ஏற்படுத்துகின்றது.
- ஒரு முறை மட்டுமே பயன்படுத்தப்பட்டு தூக்கி எறியப்படும் நெகிழிகள் குப்பைகளாக சேர்வதுடன் நமது சுற்றுப்புறத்தையும் மாசுபடுத்துகின்றன.
எந்த வகை நெகிழிகள் நமக்கு தீங்கு விளைவிப்பவை என்பதை அறிவதற்கு நெகிழிகளின் ரகசிய மொழியாகிய ரெசின் குறியீடுகளைப் பற்றி அறிந்து கொள்ள வேண்டும்.
நெகிழியின் வகைகளை அறிதல்:
ரெசின் குறியீடு:
இதில் ஒன்று நுகர்வோருக்கு பால் விநியோ கம் செய்யப் பயன்படும் நெகிழிப்பை மற்றொன்று நெகிழியால் ஆன உணவுக்கலன். அவற்றில் காட்டப்பட்டுள்ள குறியீட்டைக் கவனிக்கவும் (வட்டம்). இந்த வட்டம் எதனைக் குறிக்கிறது என்று தெரியுமா? இது ஒரு ரெசின் குறியீடு ஆகும். ரெசின் குறியீடு என்பது நெ கிழியை உருவாக்கப் பயன்படும் பலபடிமங்களைக் (Polymer) குறிக்கிறது.
ரெசின் குறியீடுகளின் தேவை:
நெகிழிகள் மறுசுழற்சி செய்யப்பட வேண்டும் அல்லது பாதுகாப்பாக அகற்றப்பட வேண் டும். நமது சுற்றுப்புறத்தை மாசுபடுத்தாமல் இருப்பதற்கா கவும், உடல் நலத்தைப் பாதிக்காமல் இருப்பதற்காகவும் ஒரு சில நெகிழிகளின் பயன்பாட்டைத் தவிர்க்க வேண்டும். ஒவ்வொரு நெகிழியும் வெவ்வேறு பல படிமங்களையோ அல்லது மூலக்கூறுகளின் தொ குப்பையோ கொண்டுள்ளது. மறுசுழற்சி செய்யப்படும்போது, ஒரு சில நெகிழிகள் ஒன்றுடன் ஒன்று கலப்பதில்லை. இது, காகிதத்தையும் கண்ணாடியையும் கலப்பதைப் போன்றதாகும். எனவே, அவை பிரிக்கப்படவேண்டும். 1988 ஆம் ஆண்டு உருவாக்கப்பட்ட, ரெசின் குறியீடுகள் வெவ்வே று வகையான நெகிழிகளை வகைப்படுத்துவதற்கான சீரான வழிமுறையாகும். இது நெகிழிகளை வகைப்படுத்துவதில், மறுசுழற்சியாளர்களுக்கு உதவுகிறது.
நெகிழிப் பொருட்களில் ரெசின் குறியீடுகளைக் காணுதல்:
இரகசியமான ரெசின் குறியீடுகள், ஒன்றையொன்று தொட்டுக் கொண்டிருக்கும் மூன்று அம்புக்குறிகளைக் கொண்ட ஒரு முக்கோணம் மூலம் காணபிக்கப்பட்டுள்ளன. அந்த முக்கோணத்தின் நடுவில் ஒரு எண் இருக்கலாம் அல்லது அதற்குக் கீழே எழுத்துக்கள் காணப்படலாம் (நெகிழி வகையின் சுருக்கக் குறியீடு). இதனைக் காண்பது என்பது கடினம். நெகிழிப் பொருளின் மீது ஒட்டப்பட்டுள்ள காகிதத்தின் மீதோ அல்லது அதன் அடிப்பகுதியிலோ இதனைக் காணலாம்.
ரெசின் குறியீடுகள் 1 முதல் 7 வரையிலான எண்களால் குறிக்கப்பட்டிருக்கும். 1 முதல் 6 வரையிலான ரெசின் குறியீடுகள் நாம் அன்றாடம் பயன்படுத்தும் நெகிழிப் பொருட்களை அடையாளப்படுத்துகின்றன. ரெசின் குறியீடு 7 என்பது 1 முதல் 6 வரையிலான ரெசின் குறியீடுகளுக்குள் வராத நெகிழியின் வகையைக் குறிப்பதற்குப் (1988 முதல்) பயன்படுத்தப்படுகிறது. ரெசின் குறீயீடுகள் மறு சுழற்சிக்கான சின்னத்தைப் போலவே இருக்கும். ஆனால், அனைத்துவித நெகிழிகளையும் மறுசுழற்சி செய்யலாம் என்பதை இது குறிக்கவில்லை.
ரெசின் குறியீடுகள் நெகிழிப் பொருள்களின் மீது எங்கு காண்பிக்கப்பட்டிருக்கும்:
- நெகிழிப் பொருளின் அடியில் இருக்கும் ரெசின் குறியீட்டைக் காண்பதற்கு, அதனை சாய்க்கவும்.
- சில நேரங்களில், அவற்றின் அடிப்ப குதியில் நெகிழி வகையின் சுருக்கக் குறியீடு மட்டுமோ அல்லது அதன் முழுப்பெ யருமோ காணப்படலாம்.
- அடியில் காணப்பட வில்லையென்றால் அதன் மேற்புறம் ஒட்டப்பட்டுள்ள அடையாளச் சீட்டின் மீது பார்க்கவும்.
- ஒரு சில நெகிழிகளில், அக்குறியீடு இருக்காது. அந்த நிறுவனமானது, விதிமுறைகளைப் பின்பற்றவில்லை. அதுபாதுகாப்பா னதா இல்லையா என்பது உங்களுக்குத் தெரியாது.
நெகிழிகளால் ஏற்படும் தீமையான விளைவுகள்:
நமது அன்றாட வாழ்விலுள்ள நெகிழிகள் இரண்டு காரணங்களுக்காக தீங்கானவைகளாகும். முதலாவது காரணம் என்னவென்றால், ஒருசில நெகிழிகள் நமது உடல்நலத்திற்குத் தீங்கு விளைவிக்கும் வேதிப் பொருள்களைக் கொண்டுள்ளன. இரண்டாவது காரணம் என்னவென்றால், பெரும்பாலான நெகிழிகள் ஒரு முறை மட்டுமே பயன்படுத்தப்படுவதற்காக உருவாக்கப்பட்டவை ஆகும். பயன்படுத்திய பிறகு தூக்கி எறியப்படவேண்டிய இந்த நெகிழிகளே நமது சுற்றுப்புறத்தில் அதிகளவு மாசுபாட்டை ஏற்படுத்துகின்றன.
தீங்கு தரும் நெகிழிகள்:
மூன்று வகையான நெகிழிப் பொருள்கள் நச்சுத்தன்மையுள்ள மற்றும் தீங்கு தரும் வேதிப்பொருள்களைக் கொண்டுள்ளன. நெகிழிப் பொருள்களுக்கு வளைவுத்தன்மை, உறுதி, வண்ணம் ஆகியவற்றை வழங்கவோ அல்லது நெருப்பு மற்றும் புறஊதாக் கதிர்களால் பாதிக்கப்படாவண்ணம் இருப்பதற்காகவோ இந்த வேதிப்பொருள்கள் சேர்க்கப்படுகின்றன. பாதுகாப்பற்ற மூன்று நெகிழிகளாவன: PVC (ரெ சின் குறியீடு 3), PS (ரெசின் குறியீடு 6, பொதுவாக தெர்மாகோல் எனப்படும்) மற்றும் PA/ ABS (ரெசின் குறியீடு 7).
PVC – பாலிவினைல் குளோரைடு நெகிழிகள்
- கன உலோகங்கள் (காட்மியம் மற்றும் காரீயம்) PVCயுடன் சேர்க்கப்பட்டுள்ளன.
- தாலேட்ஸ் (வேதியியல் சேர்க்கைப்பொருள்) நமது ஹார்மோன்களைப் பாதிக்கின்றன.
- PVC நெகிழியை எரிப்பதன் மூலம் டை ஆக்சின்கள் (மனிதர்களுக்கு மிகவும் தீமையான நக்சுத்தன்மையுள்ள வேதிப் பொருள்கள்) வெளியிடப்படுகின்றன.
PS – பாலிஸ்டைரின் நெகிழிகள்
- ஸ்டைரின் என்பது இந்தவகை நெகிழியின் கட்டுமானப் பொருளாகும். இது புற்றுநோயை விளைவிக்கும்.
- இது சிதைவுறுவதற்கு நீண்ட காலம் ஆகும் (100 முதல் 10 இலட்சம் ஆண்டுகள்).
- உணவுப்பொருள்கள் மற்றும் பானங்கள் சூடாக இருக்கும்போது, அதிக அளவிலான நச்சுத் தன்மையுள்ள ஸ்டைரினை இவை அப்பொருள்களுக்குள் வெளியிடுகின்றன.
PC – பாலிகார்பனேட் நெகிழிகள்
- PC நெகிழியானது, பிஸ்பீனால் A (BPA) என்ற பொருளைக் கொண்டுள்ளது.
- உணவு மற்றும் பானங்களுக்காக பயன்படுத்தப்படும் PC பொருள்க ளிலிருந்து BPA என்ற பொருளானது வெளியிடப்படுகிறது.
- BPA என்ற பொருளானது, ஒருசில ஹார்மோன்களின் அளவை அதிகரித்தோ அல்லது குறைத்தோ நமது உடல் செயல்படும் விதத்தை மாற்றுகிறது.
ABS – அக்ரைலோ நைட்ரைல் பியூட்டாடையீன் ஸ்டைரின் நெகிழிகள்
- நமது கண்கள், தோல், செரிமான மண்டலம் மற்றும் நுரையீரலுக்கு ஸ்டைரீன் தீங்கு விளைவிக்கிறது.
- BFR (Brominated Flame Retardants) என்ற பொருள்கள் இதில் சேர்க்கப்படுகின்றன.
- நச்சுத்தன்மையுள்ள வேதிப்பொருள்கள் இவ்வகை நெகிழியிலிருந்து கசிகின்றன.
ஒருமுறை மட்டும் பயன்படுத்தப்படக்கூடிய நெகிழிகள்
பயன்படுத்திய பின் தூக்கியெறியப்பட வேண்டிய நெகிழிகள், குறுகிய காலம் மற்றும் நீண்ட கால சுற்றுச்சூழல் பாதிப்பை ஏற்படுத்துகின்றன. உற்பத்தி செய்யப்படும் நெகிழியில் பாதியளவிற்கும் மேலானவை, பயன்படுத்தியபின் தூக்கியெறியப்பட வேண்டிய பொருள்களுக்காகவே பயன்படுகின்றன. இவை கழிவு நீர்க் குழாய்களில் அடைப்பை ஏற்படுத்தி, நீர் நிலைகளைப் பாதிக்கின்றன. இவ்வகை நெகிழிகள் தாவரங்கள், விலங்குகள் மற்றும் மனிதர்களுக்கு உடல்நலக்கேட்டை உண்டு பண்ணுகின்றன. நெகிழிப்பைகள், குவளைகள், தட்டுகள், உறிஞ்சு குழல்கள், குடிநீர் பாக்கெட் டுகள், கரண்டிகள் மற்றும் உணவுப் பொருள்களை கட்டித்தருவதற்குப் பயன்படும் நெகிழித் தாள்கள் போன்றவை இதற்கான உதாரணங்களாகும்.
இவற்றை உற்பத்தி செய்ய சில நிமிடங்களே ஆகிறது. நீங்கள் அவற்றை குறுகிய காலத்திற்கே பயன்படுத்துகிறீர்கள். ஆனால், அவை தூக்கி எறியப்படும் பொழுது ஆயிரம் ஆண்டுகளுக்கு சுற்றுச்சூழலில் இருந்து அடுத்த தலைமுறையினருக்கு மாசுபாட்டை ஏற்படுத்துகின்றன. நமது மக்களை யும் சுற்றுச்சூழலையும் பாதுகாக்க நமக்கு சட்டங்கள் தேவை.
- படிவரிசைச் சேர்மங்கள்
படி வரிசை என்பது ஒரே பொதுவான மூலக்கூறு வாய்ப்பாட்டையும் ஒத்த வேதிப் பண்புகளையும் கொண்ட ஒரே தொகுதி அல்லது ஒரே வகையில் உள்ள கரிமச் சேர்மங்களைக் குறிப்பதாகும். படிவரிசையில் அடுத்தடுத்த சேர்மங்கள் CH2 என்ற தொகுதியால் வேறுபடும்.
மீத்தேன் – CH4
ஈத்தேன் – CH3 CH3
புரப்பேன் – CH3 CH2 CH3
பியூட்டேன் – CH3 (CH2)2 CH3
பென்டேன் – CH3 (CH2) 3 CH3
மேற்கண்ட வரிசையை உற்று நோக்கும் பொழுது ஒவ்வொரு உறுப்புக்களிலும் முந்தைய உறுப்பினை விட ஒரு மெத்திலின் தொகுதி அதிகமாக இருப்பதை உணர்ந்து கொள்ளலாம். எனவே இவை படிவரிசைச் சேர்மங்கள் என்று அழைக்கப்படுகிறது.
படிவரிசை சேர்மங்களின் பண்புகள்
- ஒரு படி வரிசையில் உள்ள அடுத்தடுத்த சேர்மங்கள் மெத்திலீன் CH2 என்ற பொது வேறுபாட்டிலும் மூலக்கூறுநிறை 14 amu (அணுநிறை அலகிலும்) வேறுபடுகின்றன.
- ஒரு படி வரிசையில் உள்ள அனைத்து சேர்மங்களும் ஒரே வகை தனிமங்களையும், வினைச்செயல் தொகுதிகளையும் பெற்றிருக்கும்.
- ஒரு படிவரிசையிலுள்ள அனைத்து சேர்மங்களையும் ஒரே பொது வாய்ப்பாட்டினால் குறிப்பிட இயலும். எ.கா அல்கேன்கள் Cn H2n+1
- மூலக்கூறுநிறையின் அதிகரிப்பைப் பொறுத்து சேர்மங்களின் இயற்பண்புகள் ஒழுங்கான முறையில் மாறுகின்றன.
- எல்லாச் சேர்மங்களும் ஒத்த வேதிவினைகளில் ஈடுபடுகின்றன.
- எல்லாச் சேர்மங்களையும் ஒரே முறையில் தயாரிக்க இயலும்.
- எத்தனால் CH3CH2OH
எத்தனால் பொதுவாக ஆல்கஹால் என்று குறிப்பிடப்படுகிறது. அனைத்து விதமான ஆல்கஹால் பானங்களிலும் சில இருமல் மருந்துகளிலும் எத்தனால் உள்ளது. அதனுடைய மூலக்கூறு வாய்ப்பாடு C2H5OH. அதனுடைய கட்டமைப்பு வாய்ப்பாடு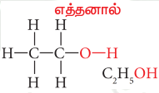
எத்தனால் தயாரிக்கும் முறை
தொழிற்சாலைகளில் கரும்புச் சாறின் கழிவுப் பாகிலிருந்து நொதித்தல் முறையில் எத்தனால் தயாரிக்கப்படுகிறது. கழிவுப்பா கு என்பது செறிவு மிகுந்த கரும்புச் சர்க்கரை கரைசலிலிருந்து சர்க்கரையை படிகமாக்கும் பொழுது மீதமுள்ளஆழ்ந்த நிறமுள்ள கூழ் போன்ற திரவமாகும். இதில் 30% சுக்ரோஸ் உள்ள து. இதை படிகமாக்கல் முறையில் பிரித்தெடுக்க இயலாது. கீழ்க்காணும் படிகள் மூலமாக கழிவுப்பாகு எத்தனாலாக மாற்றப்படுகிறது.
- கழிவுப்பாகினை நீர்த்தல்
கழிவுப்பாகிலுள்ள சர்க்கரையின் செறிவு 8 லிருந்து 10 சதவீதமாக நீரினால் நீர்க்கப்படுகிறது.
- அம்மோனியம் உப்புகள் சேர்த்தல்
நொதித்தலின்போது ஈஸ்ட்டிற்க்குத் தேவையான நைட்ரஜன் கலந்த உணவினைக் கழிவுப்பாகு கொண்டுள்ளது. நைட்ரஜன் அளவு குறைவாக இருப்பின், அம்மோனியம் சல்பேட் அல்லது அம்மோனியம் பாஸ்பேட் சேர்ப்பதன் மூலம் உர மூட்டப்படுகிறது.
- ஈஸ்ட் சேர்த்தல்
படி 2 இல்கிடைக்கும் கரைசல் பெரிய நொதித்தல் தொட்டிகளில் சேகரிக்கப்படுகிறது. பின்னர் ஈஸ்ட் சேர்க்கப்படுகிறது. கலவை 303K வெப்பநிலையில் சில நாட்களுக்கு வைக்கப்படுகிறது. அந்த நாட்களில் ஈஸ்ட்டிலுள்ள இன்வர்டேஸ், மற்றும் சைமேஸ் ஆகிய நொதிகள் சர்க்கரையை எத்தனாலாக மாற்றுகின்றன.![]()

நொதித்த நீர்மம் கழுவு நீர்மம் என அழைக்கப்படுகிறது.
- கழுவு நீர்மத்தைக் காய்ச்சி வடித்தல்
15 முதல் 18 சதவீதம் ஆல்கஹாலும் மீதிப்பகுதி நீராகவும் உள்ள நொதித்த நீர்மமானது பின்னக் காய்ச்சி வடித்தலுக்கு உட்படுத்தப்படுகிறது. முக்கியப் பின்னப்பகுதியாகக் கிடைத்த எத்தனாலின் நீர்க்கரைசல் 95.5% எத்தனாலையும் 4.5% நீரையும் பெற்றுள்ளது. இது எரிசாரயம் என அழைக்கப்படுகிறது. இக்கலவை சுமார் 5 லிருந்து 6 மணி நேரம் சுட்ட சுண்ணாம்பு சேர்த்து காய்ச்சி வடிக்கப்பட்டு 12 மணி நேரம் வைக்கப்படுகிறது. இக்கலவை மீண்டும் காய்ச்சி வடிக்கப்படும் போது தூய ஆல்கஹால் (100%) கிடைக்கிறது. இந்தத் தூய ஆல்கஹால் தனி ஆல்கஹால் எனப்படுகிறது.
இயற்பியல் பண்புகள்
- எத்தனால் இனிய மணமுடைய நிறமற்ற, எரி சுவை கொண்ட ஒரு நீர்மம். இது எளிதில் ஆவியாகக் கூடியது.
- இதன் கொதிநிலை 780C (351K). இது, அதன் ஒத்த அல்கேன்களைக் காட்டிலும் அதிகம். ஈத்தேனின் கொதிநிலை 184K
- இது நீருடன் எல்லா விகிதத்திலும் முழுவதுமாகக் கலக்கிறது.
வேதிப் பண்புகள்
(i) நீர்நீக்கம்
எத்தனாலை அதிக அளவு அடர் H2SO4 உடன் 443K க்கு வெப்பப்படுத்தும் போது மூலக்கூறினுள் நீர் நீக்கம் ஏற்பட்டு ஈத்தீனைத் தருகிறது.![]()
(ii) சோடியத்துடன் வினை
எத்தனால் சோடியத்துடன் வினைபுரிந்து சோடியம் ஈத்தாக்ஸைடையும், ஹைட்ரஜன் வாயுவையும் தருகிறது.![]()
(iii) ஆக்ஸிஜனேற்றம்
எத்தனாலைக் காரங்கலந்த KMnO4 அல்லது அமிலங்கலந்த K2Cr2O7 கொண்டு ஆக்ஸிஜனேற்றம் செய்யும் போது எத்தனாயிக் அமிலம் உருவாகிறது.![]()
இந்த வினையின் போது ஆரஞ்சு நிறமுடைய K2Cr2O7 பச்சையாக மாறுகிறது. எனவே, இது ஆல்கஹால்களைக் கண்டறியும் சோதனைக்கு பயன்படுகிறது.
(iv) எஸ்டராக்குதல்
ஆல்கஹால் கார்பாக்சிலிக் அமிலத்துடன் வினை புரிந்து பழச்சாற்றின் மணமுடைய சேர்மத்தைத் தருகிறது. இச்சேர்மம் எஸ்டர் என்று அழைக்கப்படுகிறது. எத்தனால், எத்தனாயிக் அமிலத்துடன் அடர் H2SO4 முன்னிலையில் எத்தில் எத்தனோயேட் என்ற எஸ்டரைத் தருகிறது. ஆல்கஹால், கார்பாக்ஸிலிக் அமிலத்துடன் வினைபுரிந்து உருவான சேர்மம் எஸ்டர் (பழச்சாறின் மணம் கொண்டது) எனப்படுகிறது. இந்த வினையை எஸ்டராக்குதல் என அழைக்கிறோம்.![]()
(v) ஹைட்ரஜன் நீக்கம்
எத்தனாலின் ஆவியை வெப்பப்படுத்தப்பட்ட காப்பர் வினையூக்கியின் முன்னிலையில் (573K) செலுத்தும் போது ஹைட்ரஜன் நீக்கமடைந்து அசிட்டால்டிஹைடைத் தருகிறது.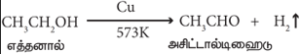
(vi) எரிதல்
எத்தனால் எளிதில் எரியக்கூடிய திரவம். ஆக்சிஜனுடன் எரிந்து கார்பன் டை ஆக்சைடையும் நீரையும் தருகிறது.![]()
பயன்கள்
- மருத்துவமனைகளில் காயங்களைத் துடைத்து எடுக்கும் புரைத் தடுப்பானாக பயன்படுகிறது.
- வாகனங்களிலுள்ள குளிர்விப்பா னில் தண்ணீர் உறைவதைத் தடுப்பதில் பயன்படுகிறது.
- பூஞ்சைகள் மற்றும் பாக்டீரியா போன்ற நுண்ணுயிரிகளை அழிக்க கைகளைத் தூய்மையாக்கும் கிருமி நாசினிகளில் (hand sanitizer) பயன்படுத்தப்படுகிறது.
- காயங்களில் கிருமி தொற்று ஏற்படாமல் பாதுகாக்கிறது.
- மருந்துகள், எண்ணெய்கள், கொழுப்புப் பொருள்கள், வாசனைப் பொருள்கள், சாயங்கள் போன்றவற்றைக் கரைக்கும் கரைப்பானாக பயன்படுகிறது.
- மெத்தில் ஆல்கஹால் கலந்த சாராயம் (95% எத்தனால் மற்றும் 5 % மெத்தனால்), பெட்ரோல் மற்றும் எத்தனால் கலந்த கலவை (ஆற்றல் ஆல்கஹால்), இயல்புத் தன்மை இழந்த ஆல்கஹால் (எத்தனால் மற்றும் பிரிடின் கலந்தவை) இவை தயாரிப்பதில் பயன்படுகிறது.
- உணவுப் பொருட்களின் சுவையை கூட்டுவதற்கு பயன்படுகிறது. உதாரணமாக வெண்ணிலாச் சாறு (vennilla essence). இது ஓர் பொதுவான உணவு சுவையூட்டி. இவை ஆல்கஹால், நீர் கலந்த கரைசலில் வெண்ணிலா விதைகள் வினைக்குட்படுத்தப்பட்டு தயாரிக்கப்படுகிறது.
- அன்றாட வாழ்வில் கரிமச் சேர்மங்கள்
மனித வாழ்வையும் கரிமச் சேர்மங்களையும் பிரிக்க இயலாது. பிறப்பு முதல் இறப்பு வரை உள்ள அனைத்து நிலைகளிலும் கரிமச் சேர்மங்கள் மனிதனுக்கு பயன்படுகின்றன. பல வகையான கரிமச் சேர்மங்களையும், அன்றாட வாழ்வில் அவற்றின் பயன்பாட்டையும் நாம் காண்போம்.
ஹைட்ரோ கார்பன்களின் பயன்கள்:
- எரிபொருள் – உதாரணமாக LPG, பெட்ரோல், மண்ணெண்ணெய்
- பல முக்கியமான செயற்கை பொருட்களின் மூலப்பொ ருட்கள்
- பல படியாக்கல் பொருட்கள். உதாரணமான டயர், நெகிழி புட்டிகள்
ஆல்கஹால்களின் பயன்கள்:
- கரைப்பான் மற்றும் புரைத்தடுப்பான்
- பல முக்கியமான செயற்கை பொருட்களின் மூலப்பொ ருட்கள்
ஆல்டிஹைடுகளின் பயன்கள்:
- பார்மால்டிஹைடு
- பல முக்கியமான செயற்கை பொருட்களின் மூலப்பொ ருட்கள்
கீட்டோன்களின் பயன்கள்:
- கரைப்பான்
- கறை நீக்கி
ஈதர்களின் பயன்கள்:
- மயக்கமூட்டி
- வலி நிவாரணி
எஸ்டர்களின் பயன்கள்:
- எல்லா சமையல் எண்ணெ ய்களிலும் லிப்பிடுகளிலும் எஸ்டர் உள்ளது.
- சோப்பு மற்றும் டிடர்ஜெண்ட்
அழுக்குகளை நீக்கவும் சுத்தப்படுத்துவதற்கும் சோப்பு மற்றும் டிடர்ஜெண்ட்கள் பயன்படுகின்றன. தூய நீரை மட்டும் பயன்படுத்தி துணிகள் மற்றும் உடல்களிலுள்ள அழுக்கு மற்றும் எண்ணெய் பொருட்களை அகற்ற முடியாது. சோப்பு மற்றும் டிடர்ஜெண்ட்களில் இருக்கும் பரப்பு இழுவிசை குறைப்பிகள், நீர் மூலக்கூறுகளை சுற்றி நின்று, பரப்பு இழுவிசையை குறைக்கின்றன. சோப்பு மற்றும் டிடர்ஜெண்ட்கள் வெவ்வேறு வேதியியல் இயல்புகளை கொண்டது. சோப்பு என்பது ஒன்று அல்லது அதற்கு மேற்பட்ட கொழுப்பு அமிலங்களின் உப்பு. இது அழுக்கு நீக்க பயன்படும் ஒரு பொருளாகும். டிடர்ஜெண்ட்களும் அழுக்கு நீக்க பயன்படும் ஒரு வேதிச் சேர்மம் அல்லது வேதி சேர்மங்களின் தொகுப்பு ஆகும். சில குறிப்பிட்ட சூழ்நிலைகளில் இரண்டு சுத்தப்படுத்தும் செயல்களை செய்கிறது. இதனை இந்த பாடத்தில் விரிவாகக் கற்றுக்கொள்வோம்.
சோப்பு:
நீளச்சங்கிலி அமைப்பை உடைய கார்பாக்சிலிக் அமிலங்களின் (கொழுப்பு அமிலங்கள்) சோடியம் அல்லது பொட்டாசியம் உப்புகளே சோப்புக்கள் ஆகும். சோப்பு தயாரிப்பதற்கு இரண்டு மூலப் பொருட்கள் தேவைப்படுகிறது. 1. கொழுப்பு 2. காரம். பெரும்பாலும் சோப்பு தயாரிக்க சோடியம் ஹைட்ராக்சைடு என்ற காரத்தை பயன்படுத்துகிறார்கள். பொட்டாசியம் ஹைட்ராக்சைடையும் கூட பயன்படுத்தலாம். பொட்டாசியத்தைஅடிப்படையாக வைத்து உருவாக்கும் சோப்பா னது சோடியத்தை அடிப்படையாக வைத்து உருவாக்கும் சோப்பை விட நீரில் எளிதில் கரைந்து போகும் தயாரிப்புகளை உருவாக்குகிறது. இதன் அடிப்படையில் சோப்பை இரு வகைகளாக பிரிக்கலாம்.
அ. கடின சோப்பு
எண்ணெய் அல்லது கொழுப்பினை எரி சோடாவுடன் (சோடியம் ஹைட்ராக்சைடு) சோப்பாக்கல் வினைக்கு உட்படுத்தும் போது கடின சோப்பு கிடைக்கிறது. பொதுவாக சலவை செய்வதற்கு இந்த வகை சோப்புகள் பயன்படுத்தப்படுகின்றன.
ஆ. மென் சோப்பு
எண்ணெய் அல்லது கொழுப்பினைபொட்டாசியம் உப்பினை பயன்படுத்தி சோப்பாக்கல் வினை உட்படுத்தும் போது மென் சோப்பு கிடைக்கிறது. உடலினை சுத்தப்படுத்துவதற்கு இந்த வகை சோப்பினை பயன்படுத்தலாம்.
சோப்பு தயாரிக்கும் முறை
குடுவை முறை
இது கொஞ்சம் பழமையான முறை. ஆனாலும் சோப்பு தயாரிக்கும் சிறுத் தொழில் நிறுவனங்களில் இந்த முறையே இன்றும் பயன்படுத்தப்படுகிறது. இரண்டு படிநிலைகளை பின்பற்றி இம்முறையில் சோப்பு தயாரிக்கப்படுகிறது.
(i). சோப்பாக்கல் வினை
சோப்பு தயாரிக்க பயன்படும் எண்ணெயை ஒரு இரும்புக் குடுவையில் எடுத்து 10% க்கும் சற்று அதிகமான காரக் கரைசலை சேர்க்க வேண்டும். இந்த கலவையின் மீது நீராவியை செலுத்தி கொதிக்க வைக்க வேண்டும். சில மணி நேரங்களுக்குப் பின் எண்ணெய் நீராற் பகுக்கப்படுகிறது. இம்முறைக்கு சோப்பாக்கல் வினை என்று பெயர்.
(ii). உப்பிடுதல்
கொதித்து கொண்டு இருக்கும் கலவையில் சாதாரண உப்பு சேர்க்கப்படுகிறது. இப்பொழுது தொட்டியின் அடியில் சோப்பு வீழ்படிவாகும். பல மணி நேரங்களுக்கு பின் சோப்பானது திரவத்தின் மேற்பரப்பில் கெட்டியான பொருளாக மிதந்து வரும் இதனை பிரித்தெடுத்து குளிர்விக்கும் போது தேவையான சோப்பு கிடைக்கிறது.
சோப்பு மீது கடின நீரின் விளைவு
கடின நீரில் இருக்கும் கால்சியம் மற்றும் மெக்னீசியம் அயனிகள் (Ca2+ மற்றும் மற்றும் Mg2+) சோப்பின் சுத்தம் செய்யும் செயலை கட்டுப்படுத்துகிறது. கடின நீர் சோப்போடு சேரும்போது ஸ்கம் (உலோக அயனிகளின் வீழ்படிவு) என்ற மெல்லிய படலம் உருவாகிறது. இது உடலிலும், துணியிலும் எளிதில் நீக்க முடியாத ஒருவகை படிவினை உருவாக்குகிறது. காலப்போக்கில் இந்த படிவு துணியின் தரத்தை குறைப்பதோடு சிறிது காலத்தில் துணியானது கிழிந்து போகவும் செய்கிறது. இதனை தவிர்க்க கடின நீரால் பாதிக்கப்படாத வேதிப் பொருட்களை பயன்படுத்தி டிடர்ஜெண்ட்கள் தயாரிக்கப்படுகிறது.
டிடர்ஜெண்ட்கள்
டிடர்ஜெண்ட்களை தயாரிப்பதன் மூலமாக சலவை துறையில் பல்வேறு மாற்றங்ள் ஏற்பட்டது. இவற்றை கடின நீர் மற்றும் அமிலம் கலந்த நீரில் கூட பயன்படுத்தலாம். சோப்பிலிருக்கும் கார்பாசிலிக் அமில உப்பினைப் போல டிடர்ஜெண்ட்கள் என்பவை சல்போனிக் அமிலம் அல்லது அல்கைல் ஹைட்ரஜன் சல்பேட்டின் உப்புகள் ஆகும். இதனால் டிடர்ஜெண்ட்கள் கடின நீரில் இருக்கும் Ca2+ மற்றும் Mg2+ஆகியவைகளுடன் சேர்ந்து வீழ்படிவாக்கலை உருவாக்குவதில்லை. எனவே சலவை செய்வதற்கு சோப்பை விட டிடர்ஜெண்ட்களே சிறந்தது.
டிடர்ஜெண்ட்களை தயாரிக்கும் முறை
பெட்ரோலியத்திலிருந்து கிடைக்கும் ஹைட்ரோ கார்பனோடு சல்பியூரிக் அமிலத்தை சேர்த்து டிடர்ஜெண்ட்கள் தயாரிக்கப்படுகிறது. இந்த வினைகள் மூலம் கிடைக்கும் மூலக்கூறுகள், சோப்பிலுள்ள கொழுப்பு அமில மூலக்கூறுகளை ஒத்து இருக்கிறது. இந்த கலவையுடன் ஒரு காரத்தினை சேர்க்கும் போது பரப்பு இழுவிசை குறைப்பி மூலக்கூறுகளை உருவாக்குகிறது. இவை கடின நீரில் உள்ள தாது உப்புகளுடன் வினை புரியாததால் கடின நீரோடு சேர்ந்து வீழ்படிவை உருவாக்குவதில்லை.
தற்போது உள்ள டிடர்ஜெண்ட்களில் பரப்பு இழுவிசை குறைப்பு மூலக்கூறுகளோடு மேலும் பல பொருட்கள் சேர்க்கப்படுகின்றன. அவைகளில் சில கீழே கொடுக்கப்பட்டுள்ளன.
- சோடியம் சிலிக்கேட்: சலவை இயந்திரங்களில் அரிப்பு ஏற்படாமல் பாதுகாக்க இது சேர்க்கப்படுகிறது.
- ஃப்ளூரெசென்ட் வெண்மை ஏற்றிகள்: துணிகள் பளிச்சிடுவதற்கு இது சேர்க்கப்படுகிறது.
- சோடியம் பெர்போரேட் (ஆக்ஸிஜன் வெளுப்பான்): சலவையின் போது சில வகை கறைகளை நீக்க பயன்படுகிறது.
- சோடியம் சல்பேட்: டிடர்ஜெண்ட் துகள் கெட்டி ஆகாமல் தடுக்க, இது பயன்படுகிறது.
- நொதிகள்: இரத்தம் மற்றும் காய்கறி சாறு போன்ற கறைகளை நீக்க இது சேர்க்கப்படுகிறது.
- சலவை செய்த பின் துணிகளில் நறுமணம் பெறுவதற்காக சில வேதிப் பொருட்கள் சேர்க்கப்படுகின்றன.
சோப்பின் தூய்மையாக்கல் வினை
ஒரு சோப்பு மூலக்கூறு வேறுபட்ட இரு வேதிப் பகுதிகளை பெற்றுள்ளன. இப்பகுதிகள் நீருடன் வேறுபட்ட முறையில் வினைபுரிகிறது. ஒரு முனை சிறிய தலை போன்ற கார்பாக்சிலேட்தொகுதி கொண்ட முனைவுள்ள பகுதியையும், மறுமுனை பெரிய வால் போன்ற நீளமான ஹைட்ரோ கார்பன் சங்கிலி தொடரையுடைய முனைவற்ற பகுதியையும் பெற்றுள்ளது.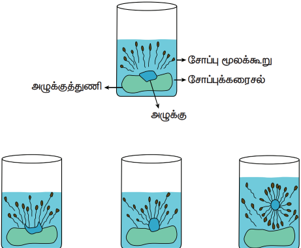
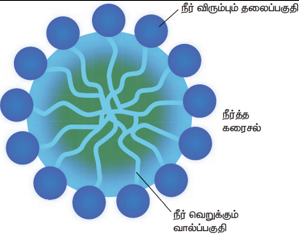
முனைவுள்ள பகுதி நீர் விரும்பும் பகுதியாக செயல்பட்டு நீருடன் ஒட்டிக் கொள்கிறது. முனைவற்ற பகுதி நீரை வெறுக்கும் பகுதியாக செயல்பட்டு ஆடைகளில் உள்ள அழுக்கு மற்றும் எண்ணெய் ஆகியவற்றுடன் ஒட்டிக் கொள்கிறது. நீரை வெறுக்கும் பகுதி மாசினை தன்னுள் அடக்கி கொள்கிறது. நீரை விரும்பும் பகுதி மொத்த மூலக்கூறையும் நீரில் கரைய செய்கிறது. சோப் அல்லது டிடர்ஜெண்டை நீரில் கரைக்கும் பொழுது சோப்பு மூலக்கூறுகள் ஒன்றாக இணைந்த கொத்துகளாக (Micelles) மீசெல்ஸ் உருவாகிறது. இந்த கொத்துகளில் ஹைட்ரோகார்பன் சங்கிலி பகுதியானது, அழுக்கு மற்றும் எண்ணெய் பகுதியோடு ஒட்டிக்கொள்கிறது. இவ்வாறாக சோப்பின் முனைவற்ற பகுதி அழுக்கைச் சுற்றிக் கொள்கிறது. சோப்பின் கார்பாக்ஸிலேட் பகுதி, கொத்துகளை நீரில் கரையச் செய்கிறது. இவ்வாறாக அழுக்கு சோப்பினால் நீக்கப்படுகிறது.
டிடர்ஜெண்ட்களின் பயன்கள்
சோப்பை விட டிடர்ஜெண்ட்களை பயன்படுத்துவது அதிக நன்மைகளை தருகிறது. ஏனென்றால்,
டிடர்ஜெண்ட்டைகடின நீர்மற்றும் மென்மையான நீர் இரண்டிலும் பயன்படுத்தலாம். கடின நீரில் சோப்பை விட டிடர்ஜெண்ட்கள் சிறப்பாக செயல் புரியும்.
- உப்பு நீர் மற்றும் அமிலம் கலந்த நீர் ஆகியவற்றில் கூட டிடர்ஜெண்ட்டை பயன்படுத்தலாம்.
- சலவை செய்யும் கலனிலோ, துணிகளிலோ, எந்த விதமான கறைகளையும், அரிப்புகளையும் டிடர்ஜெண்ட் ஏற்படுத்தாது.
- குளிர்ந்த நீரில் எளிதாக கரையும். மேலும் கடின நீரிலும் எளிதாக அலசலாம்.
- சோப்பை கொண்டு சலவை செய்ய முடியாத கம்பளி போன்ற ஆடைகளையும் டிடர்ஜெண்ட் கொண்டு சலவை செய்யலாம்.
- நீண்ட ஹைட்ரோ கார்பன் சங்கிலித் தொடரை கொண்டுள்ள டிடர்ஜெண்ட்கள் எளிதில் உயிரிய சிதைவிற்கு உட்படும்.
- வாகனங்களில் பயன்படுத்தப்படும் கிரிஸ் தயாரித்தலில் பால்மமாக்கியாக பயன்படுகிறது.
- செயற்கையாக தயாரிக்கப்படும் துணிகளை பாதுகாக்கவும், வெண்மை தன்மையுடன் பிரகாசிக்கவும் டிடர்ஜெண்ட்கள் பயன்படுத்தபடுகின்றன.
உயிரிய சிதைவு மற்றும் உயிரிய சிதைவற்ற டிடர்ஜெண்ட்கள்
அ. உயிரிய சிதைவு டிடர்ஜெண்ட்கள்
இவை நேரான ஹைட்ரோ கார்பன் சங்கிலி தொடரை பெற்றவை. இவற்றை நுண்ணுயிரிகளால் எளிதில் சிதைக்க இயலும்.
ஆ. உயிரிய சிதைவற்ற டிடர்ஜெண்ட்கள்
இவை மிகுந்த கிளைகளை உடைய ஹைட்ரோகார்பன் சங்கிலி தொடர். இவற்றை நுண்ணுயிரிகளால் எளிதாய் சிதைக்க இயலாது.
டிடர்ஜெண்ட்களின் தீமைகள்
- சில டிடர்ஜெண்ட்களின் ஹைட்ரோ கார்பன் கிளை சங்கிலி தொடரை பெற்றிருக்கும். தண்ணீரில் இருக்கும் நுண்ணுயிரிகளால் இவற்றை மக்க செய்ய இயலாது. இதனால் நீர் மாசடைந்து விடும்.
- சோப்புகளை ஒப்பிடுகையில் டிடர்ஜெண்ட்களின் விலை அதிகம்.
- சோப்பு மற்றும் டிடர்ஜெண்ட் வேறுபாடு
சோப்பு | டிடர்ஜெண்ட் |
இது நீண்ட சங்கிலி அமைப்பை பெற்ற கார்பாசிலிக் அமிலங்களின் சோடிய உப்புகள் | இது சல்போனிக் அமிலத்தின் சோடியம் உப்புகள் |
சோப்பின் அயனி பகுதி COO– Na+ | டிடர்ஜெண்டின் அயனிப்பகுதி SO3– Na+ |
விலங்குகளிடமிருந்து கிடைக்கும் கொழுப்பு மற்றும் தாவரங்களிடமிருந்து கிடைக்கும் எண்ணெய் ஆகியவற்றிலிருந்து சோப்பு தயாரிக்கப்படுகிறது. | பெட்ரோலியத்திலிருந்து கிடைக்கும் ஹைட்ரோ கார்பனிலிருந்து இவை தயாரிக்கப்படுகிறது. |
கடின நீரில் பயன்படுத்த முடியாது. | கடின நீரிலும் சிறப்பாக சலவை செய்யலாம் |
கடின நீருடன் சேரும் போது (ஸ்கம்) படிவுகளை உருவாக்கும். | கடின நீருடன் சேரும்போது (ஸ்கம்) படிவுகளை உருவாக்காது. |
குறைவான அளவில் நுரைகளை உருவாக்கும். | அதிகளவில் நுரைகளை உருவாக்கும். |
உயிரிய சிதைவு அடையும் தன்மை பெற்றது | உயிரிய சிதைவு அடையும் தன்மை அற்றது. |
- கார்பனின் புறவேற்றுமை வடிவங்கள்
கார்பன் பல்வேறு புறவேற்றுமை வடிவங்களில் காணப்படுகிறது. கிராஃபைட் மற்றும் வைரம் ஆகியன பொதுவாக காணப்படும் புறவேற்றுமை வடிவங்களாகும். கிராஃபீன், ஃபுல்லரீன்கள் மற்றும் கார்பன் நானோ குழாய்கள் ஆகியன முக்கியமான புறவேற்றுமை வடிவங்களாகும்.
கிராஃபைட், சாதாரண வெப்ப அழுத்த நிலையில், அதிக நிலைப்புத் தன்மை கொண்ட கார்பனின் புறவேற்றுமை வடிவமாகும். இது மிருதுவானது மற்றும் மின்சாரத்தை கடத்துகிறது. இது கார்பன் அணுக்களால் ஆன இருபரிமாண, தட்டையான, தாள் (sheet) போன்ற அமைப்புகளால் உருவாக்கப்பட்டுள்ளது. ஒவ்வொரு தாளும் sp2 இனக்கலப்படைந்த கார்பன் அணுக்களால் உருவான அறுங்கோண வலையாகும். இதில் C-C பிணைப்பு நீளம் 1.41 Å, இது பென்சீனில் காணப்படும் C-C பிணைப்பு நீளத்தை (1.40 Å) ஒத்துள்ளது. ஒவ்வொரு கார்பன் அணுவும், தன் இணைதிறன் கூட்டிலுள்ள நான்கு எலக்ட்ரான்களில் மூன்றைப் பயன்படுத்தி சுற்றியுள்ள மற்ற மூன்று கார்பன் அணுக்களுடன் மூன்று σ பிணைப்புகளை உருவாக்குகின்றன. இனக்கலப்பில் ஈடுபடாத p ஆர்பிட்டாலில் உள்ள நான்காவது எலக்ட்ரான் π பிணைப்பை உருவாக்குகிறது. இந்த π எலக்ட்ரான்கள் முழுத்தாள் அமைப்பின்மீது உள்ளடங்காத் தன்மையை பெற்றுள்ளன, இதுவே இதன் மின்கடத்துத் திறனுக்கு காரணமாக அமைகிறது. அடுத்தடுத்த கார்பன் தாள்கள் வலிமை குறைந்த வாண்டர் வால்ஸ் விசைகளால் ஒருங்கே இருத்தி வைக்கப்பட்டுள்ளன. அடுத்தடுத்த தாள்களுக்கு இடைப்பட்ட தூரம் 3.40 Å. கிராஃபைட் தனித்து அல்லது எண்ணெய்களுடன் கலந்து உயவுப்பொருளாக பயன்படுத்தப்படுகிறது.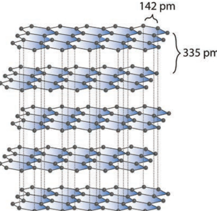
கிராஃபைட் போலல்லாமல்வைரம் மிகக்கடினமானது. வைரத்திலுள்ள கார்பன் அணுக்கள் sp3 இனக்கலப்பிலுள்ளன, மேலும் ஒவ்வொரு கார்பன் அணுவும் அதனைச் சுற்றியுள்ள நான்கு வெவ்வேறு கார்பன் அணுக்களுடன் 1.54 Å பிணைப்பு நீளமுள்ள C-C ஒற்றை பிணைப்புகளால் பிணைக்கப்பட்டுள்ளன. இதனால், படம் 2.5 இல் காட்டியவாறு ஒவ்வொரு கார்பனைச் சுற்றியும், நான்முகி அமைப்பானது படிகம் முழுவதும் விரிந்து பரவி காணப்படுகிறது. கார்பனின் நான்கு இணைதிற எலக்ட்ரான்களும் பிணைப்பில் ஈடுபட்டுள்ளன. தனி எலக்ட்ரான்கள் ஏதுமில்லாததால் மின்கடத்தும் திறனைப் பெற்றிறுக்கவில்லை. மிக்ககடினமான படிகமாக இருப்பதால், கடினமான கருவிகளை கூர்மையாக்கவும், கண்ணாடிகளை வெட்டவும், துளைப்பான்கள் செய்யவும், பாறைகளைத் துளையிடவும் பயன்படுத்தப்படுகிறது.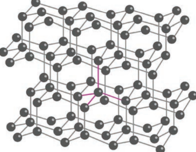
ஃபுல்லரீன்கள் புதியதாக தொகுக்கப்பட்ட கார்பனின் புறவேற்றுமை வடிவங்களாகும். கிராஃபைட் மற்றும் வைரத்தைப் போல அல்லாமல் இந்த புறவேற்றுமை வடிவங்களானவை C32, C50, C60, C70, C76 etc.. போன்ற தனித்த மூலக்கூறுகளாக உள்ளன. இந்த மூலக்கூறுகள் கூண்டு வடிவ அமைப்புகளை கொண்டுள்ளன. C60 மூலக்கூறுகள் கால்பந்து போன்ற அமைப்பை பெற்றுள்ளன. இவை பக்மின்ஸ்டர்ஃபுல்லரீன் அல்லது பக்கிபால் என்றழைக்கப்படுகின்றன. இது 20 ஆறணு வளையங்களும், 12 ஐந்தணு வளையங்களும் இணைந்த வளைய அமைப்பைப் பெற்றுள்ளது. ஒவ்வொரு கார்பன் அணுவும் sp2 இனக்கலப்படைந்து மூன்று σ பிணைப்புகளை உருவாக்குகின்றன. உள்ளடங்கா π பிணைப்பை உருவாக்கி இந்த மூலக்கூறுகளுக்கு அரோமேட்டிக் தன்மையை பெற்றுத் தருகின்றன. C-C ஒற்றை பிணைப்பின் நீளம் 1.44 Å மற்றும் C=C இரட்டை பிணைப்பின் நீளம் 1.38 Åஆகும்.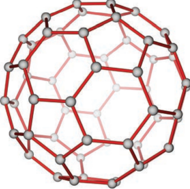
கார்பன் நானோகுழாய்கள் என்பவை புதியதாக கண்டறியப்பட்ட புறவேற்றுமை வடிவங்களாகும், இவை கிராஃபைட் போன்ற குழாய் அமைப்பையும், ஃபுல்லரீன் முனைகளையும் கொண்டுள்ளன. அச்சின் வழியாக இந்த நானோகுழாய்கள், எஃகைவிட அதிக வலிமை கொண்டவை களாக உள்ளன, மேலும் மின்சாரத்தை கடத்துகின்றன. இவை நானோ மின்னணுவியல், வினைவேகமாற்றம், பலபடிகள் மற்றும் மருந்துகள் உருவாக்கம் ஆகியவற்றில் பயன்படுகின்றன.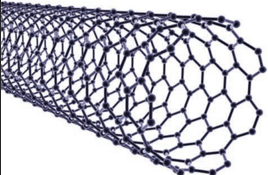
கிராஃபீன் என்பது கார்பனின் மற்றொரு புறவேற்றுமை வடிவமாகும். இது, sp2 இனக்கலப்படைந்த கார்பன் அணுக்களால் ஒற்றைத்தளத் தாள் வடிவமைப்பை பெற்றுள்ளது. கார்பன் அணுக்கள் தேன்கூடு போன்ற படிக அமைப்பில் நெருக்கமாக பொதிக்கப்பட்டுள்ளன.
- கார்பன் மோனாக்சைடு [CO]:
தயாரித்தல்
கட்டுப்படுத்தப்பட்ட அளவு ஆக்ஸிஜன் உடன் கார்பனைவினைப்படுத்தி கார்பன் மோனாக்சைடை தயாரிக்க இயலும்.![]()
தொழிற் முறையில், காற்றுடன் கார்பனை வினைப்படுத்தி கார்பன் மோனாக்சைடு தயாரிக்கப்படுகிறது. இவ்வாறு உருவாக்கப்பட்ட கார்பன் மோனாக்சைடில் நைட்ரஜன் வாயுவும் கலந்திருக்கும். நைட்ரஜன் மற்றும் கார்பன் மோனாக்சைடு சேர்ந்த கலவையானது உற்பத்தி வாயு (producer gas) என்றழைக்கப்படுகிறது.![]()
இந்த உற்பத்தி வாயுவானது, அதிக அழுத்தத்தில், காப்பர்(I) குளோரைடு கரைசலின் வழியே செலுத்தும்போது CuCl(CO).2H2 O உருவாகிறது. குறைக்கப்பட்ட அழுத்தத்தில் இக்கரைசல் தூய கார்பன் மோனாக்சைடை வெளிவிடுகிறது.
மெத்தனாயிக் அமிலத்துடன் கந்தக அமிலத்தை சேர்த்து வெப்பப்படுத்தி தூய கார்பன் மோனாக்சைடு தயாரிக்கப்படுகிறது. இங்கு, கந்தக அமிலம் நீர்நீக்கும் காரணியாக செயல்படுகிறது.![]()
பண்புகள்
இது நிறமற்ற, மணமற்ற, நச்சுத்தன்மை கொண்ட வாயுவாகும். இது நீரில் சிறிதளவு கரைகிறது. இது காற்றில் நீல நிற சுவாலையுடன் எரிந்து கார்பன் டையாக்சைடை உருவாக்குகிறது.![]()
கார்பன் மோனாக்சைடை ஒளி அல்லது மரக்கரியின் முன்னிலையில் குளோரினுடன் வினைப்படுத்தும்போது, விஷத்தன்மை கொண்ட கார்பனைல் குளோரைடை வாயுவை உருவாக்குகிறது. இது பாஸ்ஜீன் எனவும் அறியப்படுகிறது. இது ஐசோசயனேட்டுகளை தொகுக்க பயன்படுகிறது.![]()
கார்பன் மோனாக்சைடு வலிமை மிகுந்த ஒடுக்கும் காரணியாக செயலாற்றுகிறது![]()
உயர் வெப்ப, அழுத்த நிலையில் கார்பன் மோனாக்சைடு மற்றும் ஹைட்ரஜன் கலவையானது (தொகுப்பு வாயு) மெத்தனாலைத் தருகிறது.![]()
ஆக்சோ செயல்முறையில், ஈத்தேன் ஆனது கார்பன் மோனாக்சைடு மற்றும் ஹைட்ரஜன் வாயுவுடன் கலக்கப்பட்டு, புரப்பனல் (propanal) தயாரிக்கப்படுகிறது.![]()
பிஷ்ஷர் ட்ரோப்ஷ் தொகுப்பு:
கார்பன் மோனாக்சைடை, ஹைட்ரஜனுடன் சேர்த்து 50 atm க்கு குறைவான அழுத்தத்தில் உலோக வினைவேக மாற்றி முன்னிலையில் 500-700K வெப்பநிலையில் வினைப்படுத்தும்போது நிறைவுற்ற மற்றும் நிறைவுறா ஹைட்ரோகார்பன்கள் உருவாக்கப்படுகின்றன.![]()
இடைநிலை உலோகத் தனிமங்களுடன் சேர்ந்து கார்பன் மோனாக்சைடு பல்வேறு அணைவுச் சேர்மங்களை உருவாக்குகின்றன. இவற்றில் உலோகம் பூஜ்ஜிய ஆக்ஸிஜனேற்ற நிலையில் உள்ளன. உலோகத்தை, கார்பன் மோனாக்சைடுடன் வெப்பப்படுத்துவதன் மூலம் இச்சேர்மங்கள் பெறப்படுகின்றன. எடுத்துக்காட்டு. நிக்கல் டெட்ராகார்பனைல் [Ni(CO)4 ],அயர்ன் பென்டாகார்பனைல் [Fe(CO)5], குரோமியம் ஹெக்சாகார்பனைல் [Cr(CO)6].
வடிவமைப்பு:
இது நேர்க்கோட்டு அமைப்பை பெற்றுள்ளது. கார்பன் மோனாக்சைடில், கார்பனுக்கும் ஆக்ஸிஜனுக்கும் இடையே மூன்று எலக்ட்ரான் இரட்டைகள் பங்கிடப்பட்டுள்ளன. XI வகுப்பில் கற்றறிந்தபடி மூலக்கூறு ஆர்பிட்டால் கொள்கையை பயன்படுத்தி கார்பன் மோனாக்சைடில் உள்ள பிணைப்பை விளக்க முடியும். C-O பிணைப்பு நீளம் 1.128Å. பின்வரும் இரண்டு நியதி வடிவங்களின் உடனிசைவு வடிவமாக கருதப்படுகிறது.![]()
கார்பன் மோனாக்சைடின் பயன்கள்:
- ஹைட்ரஜன் மற்றும் கார்பன் மோனாக்சைடின் சமமோலார் கலவை (நீர் வாயு), கார்பன் மோனாக்சைடு மற்றும் நைட்ரஜன் ஆகியவற்றின் சமமோலார் கலவை (உற்பத்தி வாயு) ஆகியன முக்கியமான தொழிற்சாலை எரிபொருளாகும்.
- கார்பன் மோனாக்சைடு ஒரு சிறந்த ஒடுக்கும் காரணியாகும், இதனால், உலோக ஆக்சைடுகளை உலோகங்களாக ஒடுக்க முடியும்.
- கார்பன் மோனாக்சைடு ஒரு சிறந்த ஈனியாகும், இது இடைநிலை உலோகங்களுடன் இணைந்து உலோக கார்பனைல் சேர்மங்களை உருவாக்குகிறது.
- கார்பன் டை ஆக்சைடு:
கார்பன் டை ஆக்சைடு இயற்கையில் தனித்த நிலையிலும், கூட்டு சேர்மமாகவும் கிடைக்கிறது. இது காற்றின் பகுதிப் பொருளாக (0.03%) உள்ளது. இது பாறைகளில் கால்சியம் கார்பனேட்டாகவும், மெக்னீஷியம் கார்பனேட்டாகவும் காணப்படுகிறது.
தயாரித்தல்
தொழிற் முறையில், கல்கரியை அதிகளவு காற்று செலுத்தி எரித்து கார்பன் டை ஆக்சைடு பெறப்படுகிறது.![]()
சுண்ணாம்பை காற்றில்லாச் சூழலில் வறுக்கும் போது கார்பன் டை ஆக்சைடு துணைப் பொருளாக கிடைக்கிறது.![]()
ஆய்வகத்தில், உலோக கார்பனேட்டுகளின் மீது நீர்த்த ஹைட்ரோ குளோரிக் அமிலத்தை சேர்த்து வினைப்படுத்தி கார்பன் டை ஆக்சைடு தயாரிக்கப்படுகிறது.![]()
பண்புகள்
இது நிறமற்ற, தீப்பற்றாத வாயுவாகும். இது காற்றைவிட கனமானது. இதன் நிலைமாறு வெப்பநிலை 31⁰ C.எனவே, இதை எளிதில் திரவமாக்க இயலும். கார்பன் டை ஆக்சைடு அதிக நிலைப்புத்தன்மை கொண்ட சேர்மமாகும். 3100 K வெப்பநிலையிலும் கூட வெறும் 76 % மட்டுமே சிதைந்து கார்பன் மோனாக்சைடு மற்றும் ஆக்ஸிஜன் ஆகியவற்றை உருவாக்குகிறது. அதற்கும் அதிகமான வெப்பநிலையில் முற்றிலுமாக சிதைந்து கார்பன் மற்றும் ஆக்ஸிஜனைத் தடுகிறது.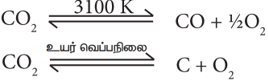
ஆக்சிஜனேற்றும் பண்பு:
உயர் வெப்பநிலைகளில் இது ஆக்சிஜனேற்றியாக செயலாற்றுகிறது. எடுத்துக்காட்டாக,![]()
நீர் வாயுச் சமநிலை:
கார்பன் டைஆக்சைடு மற்றும் ஹைட்ரஜன் வாயுவிற்கு இடையேநிகழும் வினையில் உருவாகும் சமநிலையானது பல்வேறு தொழிற்சாலைப் பயன்களைக் கொண்டுள்ளது. இச்சமநிலையானது நீர்வாயுச் சமநிலை என்றழைக்கப்படுகிறது.
அமிலப்பண்பு:
கார்பன் டையாக்சைடின் நீர்க்கரைசலில் கார்பானிக் அமிலம் உருவாவதால் சற்றே அமிலத்தன்மை கொண்டதாக உள்ளது.![]()
கார்பன் டையாக்சைடின் வடிவமைப்பு
கார்பன் டை ஆக்சைடு மூலக்கூறு நேர்க்கோட்டு வடிவத்தைப் பெற்றுள்ளது, இதில் இரண்டு C-O பிணைப்புகளும் ஒரே நீளத்தைக் கொண்டுள்ளன. இந்த மூலக்கூறில் இரண்டு C-O சிக்மா பிணைப்பு உள்ளது. கூடுதலாக ஒரு மூன்று அணுக்களையும் பிணைக்கும் வகையில் ஒரு 3c-4e பிணைப்பும் காணப்படுகிறது.![]()
கார்பன் டையாக்சைடின் பயன்கள்
- சில வேதிச் செயல்முறைகளுக்கு தேவையான, மந்தமான சூழலை உருவாக்க கார்பன் டை ஆக்சைடு, பயன்படுகிறது.
- உயிரியல் ரீதியாக, இது ஒளிச்சேர்க்கைக்கு முக்கியமானது.
- இது தீயணைப்பான்களிலும், உந்து வாயுவாகவும் பயன்படுகிறது.
- இது, கார்பன் டை ஆக்சைடு ஏற்றப்பட்ட குளிர் பானங்கள் தயாரிக்கவும், நுரைப்புகள் தயாரிக்கவும் பயன்படுகிறது.
- போரான் நியூட்ரான் கவர்தல் சிகிச்சை
போரான்-10 ஆனது நியூட்ரான் மீது கொண்டுள்ள நாட்டமே BNCT என அழைக்கப்படும் போரான் நியூட்ரான் கவர்தல் சிகிச்சையின் அடிப்படையாகும். இம்முறை மூளை கட்டிகளுக்கான ஒரு சிகிச்சை முறையாகும்.
போரான்-10ஐ குறைந்த ஆற்றலுடைய வெப்ப நியூட்ரான்களைக் கொண்டு தாக்கும் போது உருவாகும் அதிக நேரிய ஆற்றலுடைய α துகள் மற்றும் Li துகளை தரும் அணுக்கரு வினையினை அடிப்படையாகக் கொண்டது.
மூளையில் கட்டிகள் காணப்படும் நோயாளி ஒருவருக்கு போரானின் சேர்மங்கள் ஊசி வழி செலுத்தப்படுகின்றன. இவை மூளை புற்றுநோய் கட்டிகளில் சேகரமாகிறது. பின்னர்புற்றுக்கட்டிகள் காணப்படும் பகுதியினை வெப்ப நியூட்ரான்களைக் கொண்டு கதிர் வீச்சிற்கு உட்படுத்தும் போது α துகள் உருவாகிறது. இது புற்று கட்டித் திசுக்களை அழிக்கிறது. ஒவ்வொரு முறை போரான்-10 நியூட்ரானைக் கவரும் போதும் இது நிகழ்கிறது. இவ்வாறாக, புற்றுநோய் கட்டிகள் மட்டும் தொடர்ந்து அழிக்கப்படுகின்றன. பிற மூளைத்திசுக்கள் குறைந்த அளவே பாதிக்கப்படுகின்றன. கழுத்து, மார்பு, கல்லீரல் போன்ற பிறஇடங்களில் உருவாகும் புற்றுநோய்கட்டிகளின் சிகிச்சைக்கும் BNCTஐ பயன்படுத்துவது தொடர்பான ஆய்வுகள் மேற்கொள்ளப்பட்டுள்ளன.
- நைட்ரஜன்:
தயாரித்தல்: வளிமண்டலத்தின் முதன்மையான நைட்ரஜன் (78 % கனஅளவு) வாயுவானது, தொழிற்முறையில், பின்னவாலை வடித்தல் முறையில் திரவ காற்றிலிருந்து பிரித்தெடுக்கப்படுகிறது. ஏறத்தாழ 575 K வெப்பநிலையில் சோடியம் அசைடு சேர்மத்தை வெப்பச் சிதைவிற்கு உட்படுத்தி தூய நைட்ரஜனைப் பெற இயலும்.![]()
அம்மோனியாவை, புரோமின் நீர் கொண்டு ஆக்ஸிஜனேற்றம் செய்தும் இதை பெற இயலும்.
![]()
பண்புகள்
நைட்ரஜன் வாயுவானது சற்றே மந்தத் தன்மை வாய்ந்தது. பூமியில் கிடைக்கும் நைட்ரஜன் வாயுவானது முறையே 14.5% நைட்ரஜன் -14 மற்றும் 0.4% நைட்ரஜன் -15 ஐசோடோப்புகளைக் கொண்டுள்ளது. இவற்றில் நைட்ரஜன் -15 ஆனது ஐசோடோப் குறியிடுதலில் பயன்படுத்தப்படுகிறது. நைட்ரஜனின் மந்தத் தன்மைக்குக் காரணம், மூலக்கூறுகளின் அதிக பிணைப்பு ஆற்றல் மதிப்பே (225 cal mol-1 அல்லது 946kJ mol-1) ஆகும். இந்த முப்பிணைப்பு அமைப்பின் குறைந்த வினைதிறனை -C≡C-, C≡O, X-C≡N, X-N≡C, -C≡C- மற்றும் -C≡N போன்ற மற்ற முப்பிணைப்புகளைக் கொண்ட சம எலக்ட்ரான் அமைப்புகளுடன் ஒப்பிடும்போது ஆர்வத்தினைத் தூண்டுவதாக உள்ளது இந்த தொகுதிகள் ஈனிகளாக செயல்படுகின்றது ஆனால் டைநைட்ரஜன் ஈனியாக செயல்படுவதில்லை. எனினும், CO மூலக்கூறைப் போலவே, இதுவும் உலோகங்களுடன் இணைந்து குறைந்த அளவிலான அணைவுகளை (M←N≡N) உருவாக்குகிறது. லித்தியத்துடன் வினைபுரிந்து Li3N சேர்மத்தைத் தரும் வினைமட்டுமே அறைவெப்பநிலையில் நிகழும் நைட்ரஜனின் வினையாகும். மற்ற தனிமங்களுடன் நைட்ரஜன் உயர் வெப்பநிலை களில் மட்டுமே வினைபுரிகிறது. தொகுதி-2 உலோகங்கள் மற்றும் Th ஆகியன அயனி நைட்ரைடுகளை உருவாக்குகின்றன.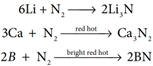
ஹைட்ரஜனுடன் நேரடியாக வினைபுரிந்து அம்மோனியாவைத் தருகிறது. இரும்பு வினைவேகமாற்றி முன்னிலையில், உகந்த வெப்பநிலையில், அதிகப்படியான அழுத்தம் இவ்வினைக்கு சாதகமாக அமைந்துள்ளது. இவ்வினையானது, ஹேபர் முறையில் அம்மோனியாவைத் தொகுத்தலுக்கான அடிப்படையாக அமைகிறது.![]()
நைட்ரஜன் உயர்வெப்பநிலைகளில் ஆக்ஸிஜனுடன் வினைப்பட்டு நைட்ரஸ் ஆக்ஸைடை உருவாக்குகிறது. 3473 K வெப்பநிலையில் கூட வெறும் 4.4% நைட்ரஸ் ஆக்ஸைடு மட்டுமே உருவாக்கப்படுகிறது.
![]()
நைட்ரஜனின் பயன்கள்:
- அம்மோனியா, நைட்ரிக் அமிலம் மற்றும் கால்சியம் சயனமைடு ஆகியவற்றின் தயாரித்தலில் நைட்ரஜன் பயன்படுகிறது.
- அதிகுளிர்நிலை அறுவைசிகிச்சைக்குத் தேவையான குறைந்த வெப்பநிலையை உருவாக்கவும், உயிரியல் பதப்படுத்தியாகவும் திரவ நைட்ரஜன் பயன்படுகிறது.
- அம்மோனியா (NH3)
தயாரித்தல்:
யூரியாவை நீராற்பகுப்பதன் மூலம் அம்மோனியா பெறப்படுகிறது.![]()
ஆய்வகத்தில் அம்மோனியம் உப்புக்களை, காரங்களுடன் சேர்த்து வெப்பப்படுத்தி நைட்ரஜன் தயாரிக்கப்படுகிறது.![]()
மெக்னீஷியம் நைட்ரைடு போன்ற உலோக நைட்ரைடுகளை நீருடன் சேர்த்து வெப்பப்படுத்துவதன் மூலமும் இதை தயாரிக்க இயலும்.![]()
இரும்பு வினைவேக மாற்றியின் மீது 750 K வெப்பநிலையில், 200 atm அழுத்தத்தில், நைட்ரஜன் மற்றும் ஹைட்ரஜன் வாயுக்கலவையை செலுத்துவதன் மூலம் தொழிற் முறையில் அம்மோனியா தயாரிக்கப்படுகிறது. (சமநிலையை விரைவாக அடைவதற்காக சிறிதளவு K2O மற்றும் Al2O3 ஆகியனவும் பயன்படுத்தப்படுகின்றன). உண்மையில், இவ்வினைக்குத் தேவையான ஹைட்ரஜன் நீர் வாயுவிலிருந்தும், திரவ காற்றை பின்ன வாலைவடித்து நைட்ரஜனும் பெறப்படுகின்றன.
பண்புகள் அம்மோனியா காற்றைவிட லேசான, கார நெடியுடைய வாயுவாகும். இதை, ஏறத்தாழ 9 வளிமண்டல அழுத்தத்தால் எளிதில் திரவமாக்க இயலும். இத்திரவத்தின் கொதிநிலை -38.4°C மற்றும் உறைநிலை -77°C. திரவ அம்மோனியாவானது இயற் பண்புகளில் நீரை ஒத்துள்ளது. அதாவது, வலிமைமிக்க ஹைட்ரஜன் பிணைப்புகளால் மூலக்கூறுகள் ஒன்றிணைக்கப்படுள்ளன. அம்மோனியாவானது, 20°C மற்றும் 760mm அழுத்தத்தில் நீரில் மிக அதிகளவில் கரைகிறது. (1 கனஅளவு நீரில் 702கனஅளவு வீதம்)
குறைந்த வெப்பநிலைகளில், NH3.H2O மற்றும் 2NH3.H2O ஆகிய கரையும் தன்மைகொண்ட இரு வெவ்வெறு நீரேறிய மூலக்கூறுகள் பிரித்தெடுக்கப்பட்டுள்ளன. இந்த மூலக்கூறுகளில், அம்மோனியா மற்றும் நீர் மூலக்கூறுகள் ஹைட்ரஜன் பிணைப்புகளால் பிணைக்கப்பட்டுள்ளன. அம்மோனியாவானது, நீர்க்கரைசல்களிலும் இதே போல நீரேற்றம் அடைகிறது, மேலும் இதை நாம் (NH3.H2O) என குறிப்பிடுகிறோம்.![]()
நீரைப்போன்றே, உயர் மின்கடத்தாப்பொருள் மாறிலி மதிப்பானது அம்மோனியாவை சிறந்த அயனியுறும் கரைப்பானாக செயல்படவைக்கிறது.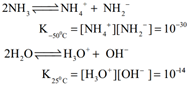
வேதிப் பண்புகள்
வெப்பத்தின் விளைவு: 500°Cக்கு அதிகமான வெப்பநிலைகளில் அம்மோனியாவானது சிதைவடைந்து அதன் தனிமங்களாக மாறுகிறது. இந்த சிதைவு வினையானது நிக்கல், இரும்பு போன்ற உலோக வினைவேக மாற்றிகளினால் தூண்டப்படலாம். தொடர்ந்த மின்பாய்ச்சலின் போது அம்மோனியா முற்றிலுமாக சிதைவடைகிறது.![]()
காற்று/ ஆக்ஸிஜனுடன் வினை: அம்மோனியா காற்றில் எரிவதில்லை, ஆனால், தூய ஆக்ஸிஜனில் மஞ்சள் சுவாலையுடன் எளிதாக எரிந்து நைட்ரஜன் வாயுவைத் தருகிறது.![]()
இது, பிளாட்டினம் போன்ற வினைவேக மாற்றியின் முன்னிலையில் எரிந்து நைட்ரிக் ஆக்சைடை உருவாக்குகிறது. இவ்வினையானது நைட்ரிக் அமிலம் தயாரிக்க பயன்படுகிறது, மேலும் இது ஆஸ்வால்ட்முறை என்றழைக்கப்படுகிறது.![]()
ஒடுக்கும் பண்பு: அம்மோனியா ஒடுக்கும் காரணியாக செயல்படுகிறது. வெப்பப்படுத்தப்பட்ட உலோக ஆக்சைடுகளின் மீது செலுத்தும்போது அவற்றை உலோகங்களாக ஒடுக்குகின்றன.![]()
அமிலங்களுடன் வினை: அமிலங்களுடன் வினைப்படுத்தும்போது இது அம்மோனியம் உப்புகளை உருவாக்குகிறது. புரோட்டான் மீதான அம்மோனியாவின் கவர்ச்சியானது நீரைவிட அதிகம் என்பதை இவ்வினை காட்டுகிறது. குளோரின் மற்றும் குளோரைடுகளுடன் வினை: குளோரின் மற்றும் குளோரைடுகளுடன் அம்மோனியா வினைப்புரிந்து இறுதி விளைபொருளாக அம்மோனியம் குளோரைடைத் தருகிறது. கீழே குறிப்பிட்டுள்ளவாறு, இந்த வினைகள் வெவ்வேறு சூழ்நிலைகளில் வெவ்வேறாக நிகழ்கின்றன.
அதிகளவு அம்மோனியா உடன்![]()
அம்மோனியா, அதிகப்படியான குளோரினுடன் வினைப்பட்டு வெடிக்கும் தன்மையுடைய நைட்ரஜன் ட்ரைகுளோரைடைத் தருகிறது.![]()
அமைடுகள் மற்றும் நைட்ரைடுகள் உருவாதல்: அம்மோனியா, அதிக நேர்மின்தன்மை கொண்ட சோடியம் போன்ற உலோகங்களுடன் அமைடுகளை உருவாக்குகிறது, ஆனால் மெக்னீஷியம் போன்ற உலோகங்களுடன் நைட்ரைடைத் தருகிறது.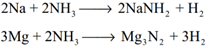
உலோக உப்புக்களுடன் வினை: அம்மோனியா, உலோக உப்புக்களுடன் வினைப்பட்டு உலோக ஹைட்ராக்சைடுகள் (Fe உடன்) அல்லது அணைவுச்சேர்மங்களை (Cu உடன்) உருவாக்குகிறது.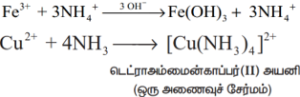
அமீன்கள் உருவாதல்: அயனி-இருமுனை கவர்ச்சியின் காரணமாக அம்மோனியா ஏற்றம் பெற்ற சேர்மங்களை அம் மோனியா உருவாக்குகிறது. எடுத்துக்காட்டு: [CaCl2.8NH3]. இதில், அம்மோனியா இருமுனையின் எதிர்முனைகள் Ca2+ அயனியை நோக்கி கவரப்படுகின்றன. அம்மோனியா மூலக்கூறானது ஈனியாகவும் செயல்பட்டு [Co(NH3)6]3+, [Ag(NH3)2]+ போன்ற அணைவுச் சேர்மங்களை உருவாக்குகிறது. எடுத்துக்காட்டாக, காப்பர் சல்பேட்டின் நீர்க்கரைசலுடன் அதிகளவு அம்மோனியாவைச் சேர்க்கும்போது அடர் நீல நிறம் கொண்ட சேர்மம் [Cu(NH3)4 ]2+ உருவாகிறது.
அம்மோனியாவின் வடிவமைப்பு: அம்மோனியா மூலக்கூறானது பிரமிடு வடிவத்தில் உள்ளது. இதில், N-H பிணைப்பு நீளம் 1.016 Å மற்றும் பிணைப்புக் கோண மதிப்பு 107°. ஒரு முனையில் ஒரு தனித்த இரட்டை எலக்ட்ரானைக்கொண்டுள்ள நான்முகி அமைப்பாக அம்மோனியாவின் வடிவமைப்பைக் கருத இயலும். எனவே இது படத்தில் காட்டியுள்ளவாறு பிரமிடு அமைப்புப் பெற்றுள்ளது.
- நைட்ரிக் அமிலம்
தயாரித்தல்
சமஅளவு பொட்டாசியம் அல்லது சோடியம் நைட்ரேட்டை, அடர் கந்தக அமிலத்துடன் சேர்த்து வெப்பப்படுத்தி நைட்ரிக் அமிலம் தயாரிக்கப்படுகிறது.![]()
நைட்ரிக் அமிலம் சிதைவடைதலைத் தடுக்கும் பொருட்டு வெப்பநிலையானது முடிந்தவரை குறைவாக வைக்கப்படுகிறது. அமிலம் குளிர்ந்து புகையும் திரவமாக மாறுகிறது. நைட்ரிக் அமிலம் சிதைவடைந்து சிறிதளவு நைட்ரஜன் டை ஆக்சைடு உருவாவதால் இத்திரவம் பழுப்பு நிறமாக காட்சியளிக்கிறது.![]()
வணிக ரீதியிலான தயாரிப்பு முறை
ஆஸ்வால்ட் முறையைப் பயன்படுத்தி அதிகளவில் நைட்ரிக் அமிலம் தயாரிக்கப்படுகிறது. இம்முறையில், ஹேபர் முறையிலிருந்து உருவான அம்மோனியாவானது பத்து மடங்கு காற்றுடன் கலக்கப்படுகிறது. இக்கலவையானது வெப்பப்படுத்தப்பட்டு, வினைவேகமாற்றி வைக்கப்பட்டுள்ள தனி அறையினுள் செலுத்தப்படுகிறது, அங்கு பிளாட்டின கம்பி வலையுடன் தொடர்பு உண்டாக்கப்படுகிறது.
வெப்பநிலை 1275 Kக்கு உயர்த்தப்படும்போது, உலோக வலையானது விரைவாக அம்மோனியாவை ஆக்ஸிஜனேற்றம் செய்து NO வாயுவை உருவாக்குகிறது, பின்னர் அது நைட்ரஜன் டையாக்சைடாக ஆக்ஸிஜனேற்றம் அடைகிறது.![]()
இவ்வாறு தயாரிக்கப்பட்ட நைட்ரஜன் டை ஆக்சைடு வாயு வரிசையாக அமைக்கப்பட்டுள்ள பரப்புகவர் கோபுரங்களின் வழியாக செலுத்தப்படுகிறது. இது நீருடன் வினைப்பட்டு நைட்ரிக் அமிலத்தை தருகிறது. உருவாக்கப்பட்ட நைட்ரிக் அமிலமானது காற்று செலுத்தி வெளுக்கப்படுகிறது.![]()
பண்புகள்
தூய நைட்ரிக் அமிலம் நிறமற்றது. இதன் கொதிநிலை 86°C. இந்த அமிலம், நீருடன் முழுமையாக கலந்து கொதிநிலை மாறா கலவையை உருவாக்குகிறது (98% HNO3, கொதிநிலை 120.5°C). புகையும் நைட்ரிக் அமிலம் நைட்ரஜனின் ஆக்ஸைடுகளை கொண்டுள்ளது. இது, சூரியஒளிக்கு வெளிப்படும்போதோ அல்லது வெப்பப்படுத்தப்படும்போதோ சிதைவடைந்து நைட்ரஜன் டை ஆக்சைடு, நீர் மற்றும் ஆக்ஸிஜனாக மாறுகிறது.![]()
இந்த வினையின் காரணமாக தூய அமிலம் அல்லது அதன் அடர்க் கரைசலானது மஞ்சள் நிறமாக மாறுகிறது. பெரும்பாலான வினைகளில் நைட்ரிக் அமிலம் ஆக்ஸிஜனேற்றியாக செயல்படுகிறது. எனவே, ஆக்ஸிஜனேற்ற நிலை +5 லிருந்து குறைந்தபட்ச மதிப்பிற்க்கு மாற்றமடைகிறது. இது உலோகங்களுடன் வினைப்பட்டு ஹைட்ரஜனைத் தருவதில்லை. நைட்ரிக் அமிலமானது, அமிலமாகவும், ஆக்ஸிஜனேற்ற காரணியாகவும் மற்றும் நைட்ரோஏற்றக் காரணியாகவும் செயல்படுகிறது.
அமிலமாக: இது, மற்ற அமிலங்களைப் போன்றே காரங்கள் மற்றும் கார ஆக்ஸைடுகளுடன் வினைப்பட்டு நீரையும் உப்புக்களையும் உருவாக்குகிறது.![]()
ஆக்ஸிஜனேற்றக் காரணியாக: கார்பன், சல்பர், பாஸ்பரஸ் மற்றும் அயோடின் போன்ற அலோகங்கள் நைட்ரிக் அமிலத்தால் ஆக்ஸிஜனேற்றமடைகின்றன.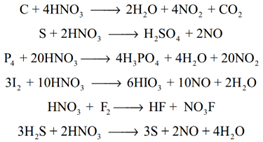
நைட்ரோ ஏற்றக் காரனியாக: பொதுவாக கரிம சேர்மங்களில் ஒரு -H அணுவை -NO2 தொகுதி கொண்டு பதிலீடு செய்தல் நைட்ரோ ஏற்றம் என குறிப்பிடப்படுகிறது. எடுத்துக்காட்டாக,![]()
நைட்ரோனியம் அயனி உருவாவதன் காரணமாக நைட்ரோ ஏற்றம் நிகழ்கிறது.![]()
உலோகங்கள் மீதான நைட்ரிக் அமிலத்தின் வினை
தங்கம், பிளாட்டினம், ரோடியம், இரிடியம் மற்றும் டாண்டுலம் போன்றவற்றைத் தவிர மற்ற எல்லா உலோகங்களும் நைட்ரிக் அமிலத்துடன் வினைபுரிகின்றன. நைட்ரிக் அமிலம் உலோகங்களை ஆக்ஸிஜனேற்றம் அடையச் செய்கிறது. அலுமினியம், இரும்பு, கோபால்ட் மற்றும் குரோமியம் போன்ற சில உலோகங்கள் அடர் நைட்ரிக் அமிலத்துடன் வினைப்ப டும்போது, அவற்றின் உலோகப் பரப்பின்மீது ஆக்ஸைடு அடுக்கு உருவாவதால் வினை செயலற்றதாகிறது. தூய உலோகத்துடன் நைட்ரிக் அமிலம் தொடர்ந்து வினைபுரிவதை இந்த ஆக்சைடு அடுக்கு தடுக்கிறது.
நைட்ரிக் அமிலமானது டின், ஆர்சனிக், அன்டிமனி மற்றும் மாலிப்டினம் போன்ற குறைந்த நேர்மின் தன்மை கொண்ட உலோகங்களுடன் உலோக ஆக்ஸைடுகளை உருவாக்குகிறது. இந்த ஆக்சைடுகளில் உலோகமானது உயர் ஆக்ஸிஜனேற்ற நிலையில் காணப்ப டுகிறது. மேலும் அமிலமானது குறைந்த ஆக்ஸிஜனேற்ற நிலைக்கு ஒடுக்கப்படுகிறது. நைட்ரிக் அமிலம் உலோகங்களுடன் வினைப்படும்போது NO2, NOவாயு மற்றும் H2O ஆகியன மிகப்பொதுவாக உருவாகும் விளைபொருட்களாகும். மிக அரிதாக N2, NH2OH மற்றும் NH3 ஆகியவனவும் உருவாக்கப்படுகின்றன.![]()
உலோகங்கள், நைட்ரிக் அமிலத்துடன் வினைபுரிவதை பின்வரும் மூன்று படிகளின் மூலம் விளக்கலாம்.
முதல் நிலை வினை: பிறவிநிலை ஹைட்ரஜன் வெளியேற்றப்பட்டு உலோக நைட்ரேட் உருவாக்கப்படுகிறது.![]()
இரண்டாம் நிலை வினை: பிறவிநிலை ஹைட்ரஜன், நைட்ரிக் அமிலத்தின் ஒடுக்க விளைப்பொருட்களை உருவாக்குகிறது.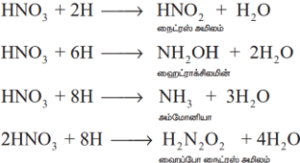
மூன்றாம் நிலை வினை: இரண்டாம் நிலை விளைப்பொருட்கள் சிதைவடைந்தோ அல்லது தொடர்ந்து வினைபுரிந்தோ இறுதி விளைப்பொருட்களை தருகின்றன.
இரண்டாம் நிலை விளைபொருட்களின் சிதைதல்: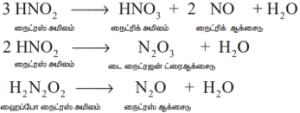
இரண்டாம் நிலை விளைபொருட்களின் தொடர் வினை: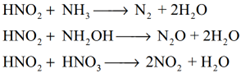
எடுத்துக்காட்டுகள்:
காப்பர், நைட்ரிக் அமிலத்துடன் பின்வருமாறு வினைபுரிகிறது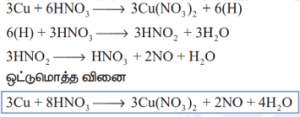
அடர் அமிலமானது, நைட்ரஜன் டை ஆக்ஸைடை உருவாக்கும் திறனைப் பெற்றுள்ளது.![]()
மெக்னீஷியம், நைட்ரிக் அமிலத்துடன் பின்வருமாறு வினைபுரிகிறது.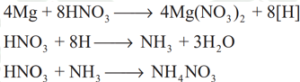
![]()
அமிலம் நீர்க்கப்பட்டிருந்தால், N2O பெறப்படுகிறது![]()
நைட்ரிக் அமிலத்தின் பயன்கள்:
- இராஜ திராவகம் தயாரித்தலில் ஆக்சிஜனேற்றியாக நைட்ரிக் அமிலம் பயன்படுகிறது.
- நைட்ரிக் அமில உப்புகள் புகைப்படத் தொழிலிலும் (AgNO3), துப்பாக்கிகளுக்கு தேவையான வெடிமருந்துகளிலும் (NaNO3) பயன்படுகின்றன.
